Sostanze pure

- 897
- 188
- Zelida Gatti
Definiamo quali sono le sostanze pure, le loro proprietà fisiche e chimiche, quali tipi ci sono e ti diamo numerosi esempi.
Quali sono le sostanze pure?
IL sostanze pure sono tutti quelli che presentano una composizione chimica costante e propria. Cioè lo sono omogeneo, Quindi sono formati solo da atomi o molecole che appaiono nei rispettivi simboli o formule chimiche.
Le sostanze pure possono essere classificate come semplice (elementi) o composti. Sono semplici quando contengono solo Un singolo tipo di atomo. Sono composti Se possiedono due o più atomi diversi formare molecole eterogenee.
Esempi di semplici sostanze pure sono oro (AU), rame (Cu) o zinco (Zn). Se troviamo altri atomi o elementi diversi, allora cessano di essere puri: oro mescolato con rame o rame miscelato con zinco. Perciò, Le miscele non sono sostanze pure.
Un esempio di sostanza pura composta è l'anidride carbonica (CO₂), composta da due atomi di ossigeno e un carbonio. Possiamo identificare che è una sostanza pura perché Puoi scrivere la tua formula.
L'acqua (H₂O) è un altro esempio di sostanza pura composta. Tuttavia, cesserà di essere puro se aggiungiamo zucchero: una miscela di zucchero e acqua è una miscela, non una sostanza pura. Lo stesso si applicherebbe se ci scioldessimo.
Proprietà delle sostanze pure
Le sostanze pure hanno una serie di proprietà fisiche e chimiche:
Omogeneità
Sono omogenei, quindi puoi dire che hanno un Composizione costanteE in tutta la sua massa o estensione.
Supponiamo di avere una sostanza pura come il ferro (fede). Se lo dividiamo in pezzi di ferro più piccoli, continuerà ad avere le stesse proprietà fisiche e chimiche.
Può servirti: propilene (C3H6)Magnitudini costanti delle sue proprietà
Avere un singolo tipo di atomi o molecole Nelle sostanze pure, le loro proprietà fisiche o chimiche sono molto ben definite e non presentano grandi varianti. Cioè, le loro proprietà hanno magnitudini o valori costanti alla stessa temperatura o pressione.
Ad esempio: l'acqua pura (H₂O) sarà sempre cristallina e bolli alla stessa temperatura. Tuttavia, se miscelato con altre sostanze, può diventare nuvoloso o cambiare colore. Quindi le sue proprietà iniziano a essere diverse: modificare la densità, la viscosità, l'odore, la temperatura alla quale congela o fa bolle, ecc.
Stati fisici diversi
Le sostanze pure possono presentare diversi stati o fasi fisiche, Mantenere la sua composizione e purezza.
L'acqua distillata è una sostanza pura formata solo da molecole H₂O. Quando si congela, si trasforma in ghiaccio, ma la sua composizione non cambia. Lo stesso accade quando evapora: le molecole H₂O rimangono le stesse.
L'acqua mantiene la sua purezza nei tre stati fisici, a meno che non si mescoli con altri elementi o composti.
Descrizione per formula chimica
Le sostanze pure possono essere descritte perfettamente con Una formula chimica.
Ad esempio, la formula H₂O descrive l'acqua e la sua molecola, quindi un serbatoio di acqua pura può essere descritto come H₂O niente di più.
Se aggiungiamo sale (NaCl) a questo serbatoio dell'acqua pura, avremo una miscela che non può più essere descritta con la formula H₂O e, quindi, non è una sostanza pura.
Quando una sostanza (liquido, solido o soda) non può essere facilmente descritta con una singola formula chimica, allora non è puro.
Tipi di sostanze pure
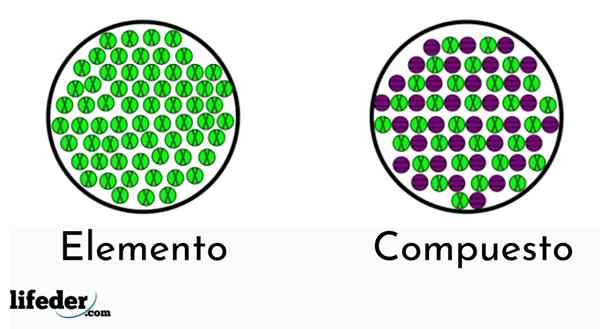 Gli elementi hanno solo un tipo di atomo, mentre i composti hanno più di un tipo
Gli elementi hanno solo un tipo di atomo, mentre i composti hanno più di un tipo Esistono due tipi di sostanze pure: i composti semplici (elementi chimici) e chimici.
Può servirti: carbonato di calcio: struttura, proprietà, formazione, usiSostanze semplici (elementi chimici)
Una sostanza costituita solo da Un tipo di atomo corrispondente a un elemento chimico può essere considerato come una sostanza pura. Questo è così che non vi è alcuna contaminazione dovuta alla presenza di atomi di un altro elemento chimico o atomi di vari elementi chimici.
L'argento puro (Ag) è formato solo da atomi di metallo argento (AG). Allo stesso modo, i pezzi di nichel (NI) o metalli di rame (Cu) possono essere considerati sostanze pure, a condizione che non siano presenti nei loro pezzi contaminazione da altri elementi chimici.
Al contrario, le leghe non sono sostanze pure, poiché derivano dalla miscela di due o più metalli. Ecco perché il bronzo o l'ottone, ad esempio, non sono sostanze pure.
Composti chimici
Una sostanza pura è un composto chimico se costituito da Due o più elementi chimici, che formano molecole eterogenee o una serie di reti ioniche (sali, ossidi, solfati, ecc.).
Un esempio di composto chimico è l'ammoniaca (NH3), formato da tre atomi di idrogeno e un atomo di azoto (NH3). Sarà una sostanza pura se tutte le sue molecole sono dello stesso tipo e hanno la formula NH3. Tuttavia, se viene miscelato con ossigeno gassoso o vapore acqueo, allora cesserà di essere una sostanza pura (sarà una miscela gassosa).
Esempi di sostanze pure
Semplici sostanze pure
- Magnesio (mg)
- Calcio (CA)
- Sodio (NA)
- Iron (Faith)
- Tin (SN)
- Ossigeno gassoso (o2)
- Helio (he)
- Mercurio (HG)
- Rame (Cu)
- Nichel (NI)
Sostanze pure composte
- Anidride carbonica (CO₂).
- Monossido di carbonio (CO).
- Glucosio (c6H12O6.).
- Acido agrumi (c6H8O7).
- Solfato di sodio (NA2SW4).
- Idrossido di sodio (NaOH).
- Acqua (h₂o).
- Carbonato di sodio (NA2Co3).
- Acido solforico (h2SW4.).
- Cloruro di sodio (NaCl).
Consigli per identificare una sostanza pura
Se puoi scrivere una formula di una sostanza o è un elemento puro, è una sostanza pura.
Temi di interesse
Miscele omogenee
Miscele eterogenee
Riferimenti
- Helmestine, Anne Marie, PH.D. Definizione di sostanza pura. Recuperato da: Thoughtco.com
- CK-12 Foundation et al. Sostanze e miscele pure. Chimica librettexts. Recuperato da: Chem.Librettexts.org


