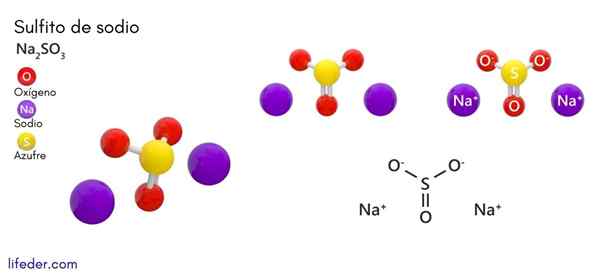
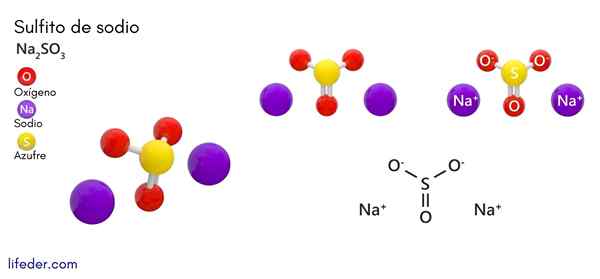
Solfito di sodio (Na2SO3)
- 4016
- 858
- Baldassarre Ross
Cos'è il solfito di sodio?
Lui solfito di sodio o solfito di sodio, la cui formula chimica è Na2SW3, È un sale sodio solubile che si ottiene come prodotto della reazione di acido zolfo (o ossido di zolfo (IV)) con idrossido di sodio.
Tra il 1650 e il 1660, Glauber iniziò a produrre solfito di sodio dal sale comune (NaCl) e acido solforico concentrato. Questo processo è considerato l'inizio dell'industria chimica.
Il processo di solfito produce polpa di legno, che si osserva come fibra di cellulosa quasi pura usando diversi sali di acido solformato per estrarre la lignina delle schegge di legno.
Pertanto, i solfiti hanno un gran numero di applicazioni di diversi tipi, anche nell'industria alimentare come additivo. Tra le sue funzioni più rilevanti, la sua doratura enzimatica e non enzimatica, controllo e inibizione della crescita microbica, prevenzione del radico ossidativo e modifica delle proprietà reologiche del cibo.
Preparazione del solfito di sodio
Generalmente, su scala di laboratorio, il solfito di sodio si verifica dalla reazione della soluzione di idrossido di sodio con gas di biossido di zolfo (2Naoh + SO2 → Na2SW3 + H2O).
Quindi l'evoluzione del SO2 Aggiungendo alcune gocce di acido cloridrico concentrato, indicherà se l'idrossido di sodio è quasi mancante, trasformato in solfito acquoso di sodio (NA2SW3 + 2HCL → 2NACL + SO2 + H2O).
D'altra parte, questo composto chimico viene ottenuto industrialmente reagendo il biossido di solfuro con una soluzione di carbonato di sodio.
Può servirti: notazione spettraleLa combinazione iniziale genera bisolfito di sodio (NAHSO3), Che reagendo con idrossido di sodio o carossido di sodio, viene convertito in solfito di sodio. Queste reazioni possono essere riassunte nella reazione globale così2 + N / a2Co3 → Na2SW3 + Co2.
Struttura chimica
Tutte le forme di solfito di sodio sono caratterizzate da solidi bianchi, cristallini e igroscopici, che hanno la capacità di attrarre e trattenere facilmente le molecole d'acqua dell'ambiente circostante, che sono normalmente a temperatura ambiente.
Il tipo di struttura cristallina è collegato alla presenza di acqua nel composto. L'anidride solfito sodico presenta una struttura ortorrombica o esagonale e, nel caso in cui vi sia una presenza di molecole d'acqua nel composto, cambia la sua struttura (ad esempio, l'eptaidrato solfito sodico presenta una struttura monoclinica).
Proprietà
Questa specie ha alcune proprietà fisiche e chimiche che la differenziano dagli altri sali, che sono descritti di seguito:
Proprietà chimiche
Come soluzione acquosa satura, questa sostanza ha un pH approssimativo di 9. Inoltre, le soluzioni esposte all'aria infine ossidano il solfato di sodio.
D'altra parte, se il solfito di sodio della soluzione acquosa può cristallizzare a temperatura ambiente o inferiore, lo fa come eptidrato. Eptahydrats Cristalli si efflore nell'aria calda e secca, si ossidano anche nell'aria per formare solfato.
In questo senso, la forma Anhydra è molto più stabile contro l'ossidazione dell'aria. Il solfito è incompatibile con acidi, ossidanti forti e alte temperature. È anche insolubile in ammoniaca e cloro.
Può servirti: alcol isopropilicoProprietà fisiche
L'anidride solfito di sodio ha una massa molare di 126,43 g/mol, una densità di 2.633 g/cm3, Un punto di fusione di 33,4 ° C (92,1 ° F o 306,5 K), un punto di ebollizione di 1.429 ° C (2.604 ° F o 1.702 K) e non è infiammabile. Inoltre, la solubilità (misurata a una temperatura di 20 ° C) è di 13,9 g/100 ml.
Usi/applicazioni
A causa delle sue proprietà reattive, il solfito di sodio è molto versatile e attualmente utilizza ampiamente tipi di industrie.
- È ampiamente usato nel trattamento delle acque e nell'eliminazione dell'ossigeno disciolto nelle caldaie dell'acqua.
- Ha anche applicazioni nell'industria cartacea (semi -kid polpa).
- Nella fotografia viene utilizzato nella produzione di rivelazione.
- In una misura adeguata viene utilizzato nella conservazione degli alimenti e degli antiossidanti.
- Nel settore tessile viene utilizzato nei processi di riciclaggio e anticloro.
- Viene anche usato come agente riducente.
- Inoltre, viene utilizzato nel recupero secondario dei pozzi petroliferi.
- È persino utilizzato nella produzione di composti organici, coloranti, inchiostri, rayon viscoso e gomme.
- È usato nella produzione di numerosi prodotti chimici, tra cui solfato di potassio, solfito di sodio, silicato di sodio, iposolfito di sodio e solfato di sodio in alluminio.
Rischi
Effetti per l'esposizione al composto
L'esposizione prolungata o ripetuta a questa sostanza può causare dermatite e reazioni di sensibilità. Esposizione in solfito sensibile, asmatico e atopico.
Allo stesso modo, la decomposizione acida del solfito di sodio può rilasciare fumo tossico e pericoloso di ossidi di zolfo, incluso l'anidride solforosa, che può causare un deterioramento polmonare permanente a causa dell'esposizione cronica e acuta.
Può servirti: Ididio 192Allo stesso modo, l'avvelenamento acuto per biossido di zolfo è raro perché il gas viene facilmente rilevato. È così irritante che il contatto non può essere tollerato.
Tra i sintomi, la tosse, le voci, gli starnuti, la lacerazione e la respirazione sono inclusi. Tuttavia, i dipendenti con un'elevata inevitabile esposizione possono subire un danno polmonare importante e possibilmente mortale.
Ecotossicità
Il solfito di sodio è una soluzione non hazardosa, che è comunemente usata come agente residuo di declino dell'acqua. Le alte concentrazioni contribuiscono ad alta domanda di ossigeno chimico in ambienti acquatici.
Consumo alimentare con conservanti
Uno degli additivi che possono causare problemi nelle persone sensibili è il gruppo noto come agenti di solfitazione, che include diversi additivi inorganici di solfito (E220-228), incluso il solfito di sodio (così2).
Nelle persone ipersensibili o asmatiche, il consumo di alimenti con solfiti o l'inalazione di anidride solforosa, può essere tossico.
Questi composti sono responsabili del bronch-vincolo che si traduce in difficoltà respiratorie. L'unico trattamento per questa reazione eccessiva è evitare cibo e bevande contenenti solfiti.