Alluminio solfato (AL2 (SO4) 3)

- 2299
- 634
- Rufo Longo
 Cristalli di solfato in alluminio bianco
Cristalli di solfato in alluminio bianco Cos'è il solfato di alluminio?
Lui solfato di alluminio È una formula inorganica sale in alluminio al2(SW4)3, che di solito si verifica come un solido bianco di cristalli lucenti. Il colore del composto sarà influenzato dalla sua concentrazione di ferro e da qualsiasi altra impurità. Esistono due tipi principali di solfato di alluminio: A e B.
È un sale molto solubile, e in natura è raro trovarlo nella sua forma anidra. Di solito è idratato a forma di solfato di alluminio ottadecaidrato [a2(SW4)3.18h2O] o esadecaidrate [a2(SW4)3.16h2O].
Può anche formare doppi sali con potassio e con ammonio, composti noti come luci. In parte ciò può essere dovuto all'affinità dell'acqua all'interno degli idrati per trattenere altri ioni, oltre all'alluminio.
Struttura chimica del solfato di alluminio
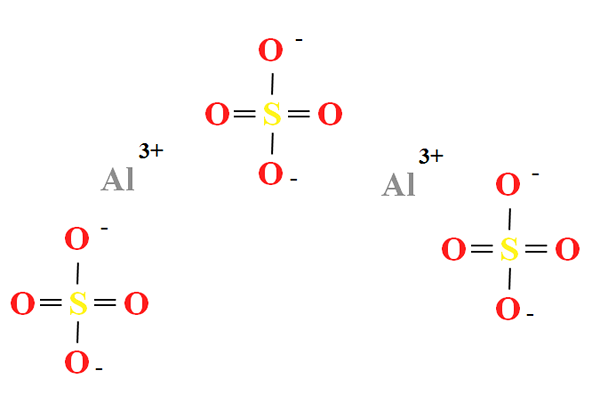 Struttura chimica del solfato di alluminio. Fonte: Gabriel Bolívar
Struttura chimica del solfato di alluminio. Fonte: Gabriel Bolívar Il solfato di alluminio ha una percentuale di due cationi a3+ Per ogni tre anioni così42- (immagine superiore), che può essere osservata direttamente nella sua formula chimica al2(SW4)3.
Notare che3+ Sono grigiastri, mentre i SOS42- Sono gialli (per l'atomo di zolfo) e rosso (da atomi di ossigeno).
La struttura illustrata corrisponde alla forma anidra di Al2(SW4)3, Dal momento che nessuna molecola d'acqua interagisce con gli ioni. Nei suoi idrati, tuttavia, l'acqua può essere attratta dai centri positivi di AL3+, o per il tetraedra negativo di SO42- mediante ponti idrogeno (hah-so-so32-).
Al2(SW4)3∙ 18h2Oppure, ad esempio, contiene 18 molecole d'acqua nella sua struttura solida. Alcuni di loro potrebbero essere in contatto diretto con lui3+ o con il SOS42-. In altre parole: il solfato di alluminio può avere acqua di coordinazione interna o esterna.
Inoltre, la sua struttura può ospitare altri cationi come la fede3+, N / a+, K+, eccetera. Ma per questo, è necessaria la presenza di più sotto gli anioni42-, per neutralizzare l'aumento dei carichi positivi a causa di impurità metalliche.
Il solfato di alluminio può avere molte strutture, sebbene i suoi idrati tendano ad adottare il sistema cristallino monoclinico.
Proprietà fisiche e chimiche
Aspetto
È presentato come un solido con cristalli bianchi lampeggianti, granuli o polvere.
Peso molecolare
342,31 g/mol (anidro).
Odore
È un bagno.
Gusto
Gusto dolce, moderatamente astringente.
Punto di fusione
Forma anhydra a 770º C (forma di ottadecaidrate 86,5º C).
Solubilità dell'acqua
31,2 g/100 ml a 0º C; 36,4 g/100 ml a 20º C e 89 g/100 ml a 100º C.
Densità
Da 2,67 a 2,71 g/cm3.
Solubilità
Leggermente solubile in alcol etilico.
Pressione del vapore
Essenzialmente zero.
Stabilità
Aria in aria.
Decomposizione
Se riscaldato, approssimativamente al suo punto di fusione, può essere rotto emettendo in particolare ossido di zolfo, un gas tossico.
Corrosività
Le soluzioni di alluminio solfato sono corrosive per l'alluminio. Inoltre, il composto può corrodere i metalli in presenza di umidità.
Può servirti: gluconeogenesiPKA
Da 3.3 a 3.6. E il suo pH è 2,9 o più in una soluzione acquosa al 5%.
Usi di solfato di alluminio
Coagulazione o flocculazione dell'acqua
- Se miscelato con acqua (potabile, servita o rifiuti), il solfato di alluminio provoca idrossido di alluminio, che forma complesso con composti e particelle in soluzione accelerando la sua sedimentazione, che in assenza di trattamento con solfato di alluminio richiederebbe un ritardo a lungo.
- Il solfato di alluminio viene anche utilizzato per pulire l'acqua della piscina, rendendoli più attraenti da usare.
- Attraverso l'uso di solfato di alluminio, si ottiene un'acqua priva di torbidità e colore, aumentando la sua potabilità facilitando la pulizia dell'acqua. Sfortunatamente questo metodo di purificazione può portare a una concentrazione di alluminio leggermente aumentata nell'acqua.
- L'alluminio è un metallo molto tossico che si accumula nella pelle, nel cervello e nei polmoni, causando disturbi gravi. Inoltre, non si sa quale funzione compie negli esseri viventi.
- L'Unione Europea richiede che il limite massimo consentito dell'alluminio nell'acqua non superi 0,2 mg/L. D'altra parte, l'agenzia di protezione ambientale statunitense richiede che il limite massimo di inquinamento idrico con alluminio non superi 0,05-0,2 mg/l.
- Il trattamento delle acque utilizzate o servite con solfato di alluminio consente l'eliminazione o la riduzione del fosforo in essi, economicamente.
Uso come inchiostro mordant e nell'elaborazione del documento
- Il solfato di alluminio è stato usato come mordente di coloranti o inchiostri, aiutando a guardare il materiale tessile. La sua azione di fissaggio è dovuta ad al (OH)3, la cui coerenza gelatinosa collabora con l'adsorbimento dei coloranti sui tessuti.
- Sebbene sia stato utilizzato da circa 2000 a.C. Con lo scopo descritto, solo i coloranti organici richiedono mordenti. I coloranti sintetici, d'altra parte, non richiedono ai mordenti di svolgere la loro funzione.
- È stato spostato dalla produzione di carta, ma è ancora utilizzato nell'elaborazione della polpa di carta. Rimuovi le tue impurità e è stato utilizzato per collegare i materiali, neutralizzare i carichi e calibrare la colophony.
Usi industriali
- Viene utilizzato nel settore delle costruzioni per accelerare l'ambiente concreto. Inoltre, viene utilizzato nell'imperttualizzazione delle costruzioni.
- Nell'industria dei saponi e dei grassi è utilizzato nella produzione di glicerina.
- Nell'industria petrolifera, per l'elaborazione dei catalizzatori sintetici che usano durante il loro funzionamento.
- È usato nell'industria farmaceutica come astringente nella preparazione di farmaci e cosmetici.
- Interviene nell'elaborazione di coloranti come Carmine. Viene anche usato come colorante nella fabbricazione di buttadiene di gomma sintetica streto.
- Nel settore manifatturiero dello zucchero viene utilizzato come purificatore della melassa di canna da zucchero.
- È usato nella produzione di deodoranti, in quanto causa il restringimento dei condotti del condotto delle ghiandole sudori.
- È utilizzato in abbronzatura in pelle, un processo necessario per l'uso. Inoltre, viene utilizzato nella produzione di fertilizzanti.
- È usato come additivo nell'elaborazione di dipinti, adesivi e sigillanti, nonché prodotti per la pulizia e la cura dei mobili.
Usi medicinali e terapeutici
- Il solfato di alluminio è un adiuvante immunitario. Pertanto, svolge la funzione di elaborazione degli antigeni in modo tale che quando vengono rilasciati nel loro luogo d'azione, producono una maggiore produzione di anticorpi per gli antigeni che sono stati inoculati.
- Adiuvante Freund e BCG, così come gli altri adiuvanti, compresi endogeni come le interleuchine, non sono specifici per gli antigeni, consentendo un aumento del raggio dell'azione immunitaria. Ciò ha permesso l'elaborazione dei vaccini contro numerose malattie.
- L'azione coagulante del solfato di alluminio ha permesso l'eliminazione di numerosi virus nell'acqua trattata, come la beta, MS2, T4 e P1, tra gli altri. I risultati indicano che il trattamento dell'acqua con solfato di alluminio produce un'inattivazione di tali virus.
- Il solfato di alluminio viene utilizzato in una barra o come polvere nel trattamento di piccole ferite superficiali o abrasioni prodotte dalla rasatura.
- Viene utilizzato nella produzione di acetato di alluminio, composto utilizzato nel trattamento di alcune condizioni dell'orecchio. È stato anche usato, senza un successo significativo, per alleviare le conseguenze dei morsi delle formiche di fuoco.
- Le soluzioni di solfato di alluminio vengono utilizzate, ad una concentrazione dal 5% al 10%, nel trattamento locale delle ulcere che consentono il controllo delle loro secrezioni.
- L'azione astringente di alluminio solfato contrae gli strati superficiali della pelle, le proteine coagulate e le ferite curative.
Altri usi
- Il solfato di alluminio aiuta nel controllo dell'eccessiva crescita delle alghe in stagni, laghi e correnti d'acqua. È anche usato nell'eliminazione dei molluschi, tra questi, la lumaca spagnola.
- I giardinieri applicano questo composto per acidificare i terreni alcalini. In contatto con la loro acqua, il solfato di alluminio si decompone in idrossido di alluminio e acido solforico diluito. Quindi, l'idrossido di alluminio precipita, rimanente acido solforico.
- L'acidificazione dei terreni dovuti all'acido solforico viene visualizzata in modo molto creativo, a causa dell'esistenza di una pianta chiamata ortensia, i cui fiori diventano blu in presenza di un terreno acido; cioè, sono sensibili e rispondono ai cambiamenti di pH.
- Il solfato di alluminio interviene nell'elaborazione di una schiuma per combattere e controllare il fuoco: reagisce con il bicarbonato di sodio, producendo il rilascio di CO2. Questo gas blocca l'accesso di O2 al sito di combustione del materiale e di conseguenza la cessazione del fuoco che veniva sviluppato.
Produzione di solfato di alluminio
Il solfato di alluminio viene sintetizzato reagendo un composto ricco di alluminio, come il minerale della bauxite, con acido solforico ad alte temperature. La seguente equazione chimica rappresenta la reazione:
Al2O3 + H2SW4 -> Al2(SW4)3 + 3 h2O
Il solfato di alluminio può anche formarsi attraverso una reazione di neutralizzazione tra idrossido di alluminio e acido solforico, secondo la seguente reazione:
2 a (oh)3 + 3 h2SW4 + 12 h2O -> a2(SW4)3.18h2O
L'acido solforico reagisce con l'alluminio per formare solfato di ammonio e il rilascio di molecole di idrogeno sotto forma di gas. La reazione è schematizzata come segue:
Da 2 a +3 h2SW4 -> Al2(SW4)3 + 3 h2
Tipi di solfato di alluminio
Il solfato di alluminio è classificato in due tipi: Tipo A e Tipo B. Nel solfato di alluminio di tipo A, i solidi sono bianchi e hanno una concentrazione di ferro inferiore allo 0,5%.
Nel solfato di alluminio di tipo B, i solidi sono marroni e hanno una concentrazione di ferro inferiore all'1,5%.
Esistono industrie che producono solfato in alluminio che hanno criteri diversi per la classificazione. Pertanto, un'industria riferisce per la sua preparazione del tipo di solfato di alluminio a una concentrazione massima di ferro 0,1% come ossido ferrico.
Mentre per il tipo B indicano una concentrazione massima di ferro dello 0,35%.
Tossicità in alluminio solfato
- Il solfato di alluminio è un composto che esercita la sua azione tossica per contatto con la sua polvere, causando così l'irritazione della pelle e nei casi in cui il contatto è frequente, dermatite.
- Agli occhi provoca una forte irritazione, producendo anche lesioni permanenti.
- La sua inalazione produce irritazione del naso e della gola, che può causare tosse e Carraspera.
- La sua assunzione provoca irritazione gastrica, nausea e vomito.
- Ci sono effetti tossici che sebbene non siano dovuti direttamente al solfato di alluminio, sono indirettamente per il loro uso. Questo è il caso di alcuni effetti tossici dell'alluminio, causato dall'uso del solfato di alluminio nella purificazione dell'acqua.
- I pazienti che sono cronicamente dializzati usando sali preparati in acqua purificata attraverso l'uso di solfato di alluminio, sperimentano disturbi della salute molto gravi. Tra questi disturbi menzioniamo anemia, demenza di dialisi e un aumento delle malattie ossee.
Riferimenti
- Wikipedia. (2018). Solfato di alluminio. Preso da: in.Wikipedia.org
- ARIS industriale. Solfato di alluminio tipo A e b. Preso da: Aris.com.PE
- Christopher Boyd. (9 giugno 2014). I migliori usi industriali per il solfato di alluminio. Preso da: Chemservice.com
- PUBCHEM. (2018). Alluminio solfato anidro. Preso da: pubchem.NCBI.Nlm.NIH.Gov
- Andesia chimica. (20 agosto 2009). Foglio di sicurezza in alluminio solfato. [PDF]. Preso da: Andesia.com
- Libro chimico. (2017). Solfato di alluminio. Preso da: chimico.com

