Caratteristiche Samario, struttura, ottenimento, usi

- 1224
- 80
- Lidia Valentini
Lui samario È un elemento chimico appartenente alle terre rare, in particolare ai lantanidi, e il cui simbolo è SM. Il suo nome viene dal minerale di Samarskita, in onore del colonnello Vassili Samarsky, che era un ufficiale minerario russo e che ha donato campioni di questo minerale per il suo studio. Il chimico francese, Paul Émile Lecoq, ottenne il suo ossido e alcuni dei suoi sali dalla Samarskita nel 1879, mentre lavorava a Parigi.
Lecoq di Boisbaudran è di solito concesso il merito per la scoperta del samarium, sebbene ci fossero altri prodotti chimici e mineralogici che in precedenza hanno disegnato la strada per trovarlo. Fu solo nel 1901 che il chimico francese Eugène Anatole riuscì a produrre il primo campione di samarium puro.
 Samario Samario è stato conservato strettamente all'interno di una blister. Fonte: immagini ad alta risoluzione degli elementi chimici/cc di (https: // creativeCommons.Org/licenze/di/3.0)
Samario Samario è stato conservato strettamente all'interno di una blister. Fonte: immagini ad alta risoluzione degli elementi chimici/cc di (https: // creativeCommons.Org/licenze/di/3.0) La ragione di questo ritardo nel suo isolamento era dovuta al fatto che il Samario è un metallo relativamente reattivo, quindi non è di natura pura, ma fa parte di molte masse minerali. Allo stesso modo, mantiene una stretta relazione geologica con altri elementi di terre rare come l'Europio e il Neodimio, quindi è difficile separarlo da tali inquinanti.
Samario è un metallo con applicazioni molto diverse, utilizzate per cancro, appuntamenti, reattori nucleari, magneti organici e catalisi.
[TOC]
Caratteristiche Samario
Fisico
Il Samario ha una lucentezza bianca d'argento, ma questo diventa rapidamente oro2O3, che si chiama samaria. È uno dei metalli Lantanide più difficili e volatili, con 1072 e 1900 ºC di fusione e punti di ebollizione, rispettivamente.
Si ossida con lentezza relativa se esposta all'aria o sommersa in olio minerale. Ecco perché deve essere conservato in vesciche o all'interno di contenitori sigillati con argon o qualsiasi altro gas inerte. Se riscaldato a 150 ºC, si ossida vigorosamente, dicendo che brucia scintille se giace duramente.
Può servirti: Lutecio: struttura, proprietà, usi, ottenendoSostanze chimiche
Il Samario, come gli altri Lantanidi, mostra uno stato di ossidazione di +3 in quasi tutti i suoi composti; cioè, si trova come un sm cation3+. Tuttavia, è anche in grado di adottare lo stato di ossidazione di +2, SM2+, essere in composti come SMO (samarium monossido), SMS (samarium monosolfuro) e SMI2 (Samario Diyoduro).
Si dissolve in acqua calda e soprattutto in acidi diluiti, come HCl, H2SW4 e ch3COOH; Con l'eccezione di HF, perché forma uno strato protettivo SMF3 rallentando la sua dissoluzione. Il tuo ossido, SM2O3, È moderatamente semplice, quindi quando si dissolve in acqua rilascerà notevoli quantità di ioni OH- Mediante azione dell'idrossido SM (OH)3.
La maggior parte dei composti del samarium +3 sono caratterizzati da colori giallo-greenish e alcuni si distinguono per essere luminescenti.
Struttura chimica
A temperatura ambiente, il samarium adotta una struttura cristallina romboedrica, che corrisponde al polimorfo o alla fase α. Quando viene riscaldato a 731 ºC, si verifica una transizione di fase, densificando i suoi cristalli in una struttura esagonale compatta (HCP), chiamata fase β β β.
Continuando il riscaldamento a una temperatura di 922 ºC, il Samario subisce un'altra transizione verso una struttura cubica centrata nel corpo (BCC), chiamata fase γ.
I cristalli Samario possono anche subire altre transizioni quando sono compressi sotto elevate pressioni, nell'ordine di migliaia di kilobare, essendo il tetragonale e doppio compatto esagonale (DHCP) alcune delle strutture ottenute in questi studi.
Configurazione elettronica
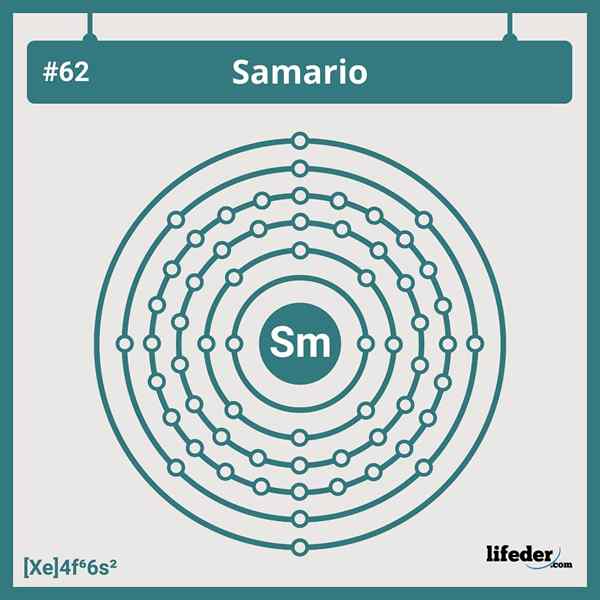 Configurazione elettronica Samario
Configurazione elettronica Samario La configurazione elettronica abbreviata del Samario è:
Può servirti: diidrossicetone fosfato (DHAP): caratteristiche e applicazioni[Xe] 6s24f6
Ha sei elettroni nei suoi orbitali 4F, che concorda con la sua posizione nel sesto gruppo dei Lanthanides. Pertanto, la sua configurazione elettronica non riguarda nessuna delle molte deviazioni che vediamo nella tabella periodica.
Ottenimento
 Sabbia minerale monazita, materia prima principale per ottenere il samarium. Fonte: d. Kemp, a. C. Cilliersslight leggermente modificato da Gretarsson (sostituito da bar rosso, scarsamente visibile da uno bianco)/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)
Sabbia minerale monazita, materia prima principale per ottenere il samarium. Fonte: d. Kemp, a. C. Cilliersslight leggermente modificato da Gretarsson (sostituito da bar rosso, scarsamente visibile da uno bianco)/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0) Nonostante faccia parte delle terre rare, l'abbondanza del Samario è superiore a quella di stagno e altri metalli. È associato alla ruggine dei metalli delle terre rare, componendo questi minerali come Cerita, La Gadolinita, La Monazita e La Bastnasita, la monazite è una delle sue principali fonti mineralogiche, in quanto contiene circa 2.8% di samarium.
Esistono diversi metodi per ottenerlo. Uno di questi consiste nel trasformare le sabbie monazite e separare gli ioni SM3+, o da soluzioni e successive estrazioni di solventi o utilizzando la cromatografia a scambio ionico.
Gli ioni di Samario sono ottenuti come SMCL3, Sono sottoposti a elettrolisi con una miscela fusa di NaCl o CACL2. D'altra parte, se questi ioni sono ottenuti come SM2O3, Quindi l'ossido viene ridotto in uno scioglimento del tantatalium usando Lantano, dove i vapori di samarium vengono distillati a causa del loro punto di ebollizione inferiore. L'equazione per questa riduzione è la seguente:
VOI2O3 + 2la → 2Sm + il2O3
La riduzione viene eseguita calda (vicino a 1400 ° C) e all'interno di un forno a induzione a vuoto, che accelera ulteriormente la distillazione dei vapori risultanti dal samarium.
Usi/applicazioni del samario
Magneti
 I magneti SMCO sono usati come parte dei componenti funzionali degli orologi al quarzo. Fonte: © 2010 di Tomasz Sienicki [Utente: TSCA, Mail: Tomasz.Sienicki a Gmail.com]/cc di (https: // creativeCommons.Org/licenze/di/3.0)
I magneti SMCO sono usati come parte dei componenti funzionali degli orologi al quarzo. Fonte: © 2010 di Tomasz Sienicki [Utente: TSCA, Mail: Tomasz.Sienicki a Gmail.com]/cc di (https: // creativeCommons.Org/licenze/di/3.0) Il Samario è legato con il cobalto per dare origine alle leghe SMCO, la cui magnetizzazione è permanente e circa 10000 volte superiore a quella del ferro.
Può servirti: operazioni unitarieQuesti magneti Samario-Colto sono utilizzati principalmente nelle persiane delle telecamere, cuffie, motori, pillole di chitarra elettrica e nelle applicazioni militari in cui supportano temperature superiori a 400 ° C.
Medicinale
 Quadramet a struttura molecolare, 153SM-EDTMP.
Quadramet a struttura molecolare, 153SM-EDTMP. Il Samario stesso è relativamente tossico. Tuttavia, uno dei suoi isotopi radioattivi, il 153SM, lamentata da una molecola EDTMP (etilendiaminotetrametilene -fosfonato, immagine sopra), serve a combattere il dolore nel trattamento di tumori della prostata, polmone e seno. Questo medicinale si chiama lexidronam Samario (153SM), commercialmente noto come Quadramet.
Reattori nucleari
L'isotopo 149SM è un eccellente assorbimento di neutroni, quindi viene utilizzato nei reattori nucleari per controllare le reazioni e prevenire un'esplosione.
elettronica
L'SMS fa la differenza di temperatura nell'elettricità, quindi viene utilizzato come termoelettrico in diverse apparecchiature. Ha anche la peculiarità di diventare metallico in pressioni relativamente basse.
Datazione
Il decadimento alfa dell'isotopo 147Voi (T1/2= 1.06 × 10undici) all'isotopo 143Nd, è usato fino ad oggi campioni di rocce o meteoriti all'interno o all'esterno della terra. Ha il vantaggio che gli atomi 147SM e 143Condividi le stesse caratteristiche geologiche, cioè non soffrono di grandi separazioni durante i processi metamorfici.
Catalisi
Il Samario è usato nella sintesi organica come SMI2, Agire come agente riducente in numerose sintesi di versioni sintetiche dei prodotti naturali. D'altra parte, il SM2O3 È un catalizzatore per la disidratazione e la deidrogenazione dell'etanolo.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Samario. Recuperato da: in.Wikipedia.org
- Oleg d. Neikov e Stanislav s. (2019). Manuale di polveri in metallo non ferroso: tecnologie e applicazioni. (Seconda edizione). Scienceirect.
- I redattori di Enyclopedia Britannica. (2020). Samario. Recuperato da: Britannica.com
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Samario. Elemento pubchem. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Dottore. Doug Stewart. (2020). Fatti per elementi samarium. Recuperato da: Chemicool.com
- Strekopytov, s. (2016). Salute al samarium. Nature Chem 8, 816. doi.org/10.1038/nhem.2565

