Struttura radio, proprietà, usi, ottenendo
- 1849
- 416
- Dott. Rodolfo Gatti
Lui Radio È un elemento metallico appartenente al gruppo 2 della tavola periodica, i metalli alcalinotherro, il cui simbolo chimico è RA. È l'ultimo membro di questo gruppo, situato sotto il bario, e precedenti elementi radioattivi come il torio e l'uranio; Tuttavia, il raggio è circa un milione di volte più radioattivo e, quindi, più pericoloso dello stesso uranio.
È un elemento circondato da storie incredibili e sfortunate, tutte a seguito dell'ignoranza dei suoi effetti negativi sulla salute. La luminosità bluastra dei loro sali e delle soluzioni acquose affascinava gli scienziati Pierre e Marie Curie, che lo scoprirono nell'anno del 1898 analizzando una radiazione inspiegabile e forte dai campioni del minerale di Pechblenda, a cui il loro contenuto di uranio aveva rimosso il contenuto di uranio e polonio.
 Illustrazione di Marie Curie, scopritore della radio
Illustrazione di Marie Curie, scopritore della radio Eliminato l'uranio e il polonio, il curie e concluse che c'era un altro elemento presente nella Pechblenda, responsabile della forte radiazione, che ingegnosamente poteva quantificare. Questo nuovo elemento era chimicamente molto simile al bario; Tuttavia, a differenza delle sue linee verdi spettrali, quelle di questo erano di colore carminio.
Pertanto, dopo l'elaborazione, purificare e analizzare tonnellate di pechblenda, hanno ottenuto 0.1 mg di racl2. A quel punto, nel 1902, avevano già determinato la massa atomica della radio, il cui nome derivava dal "raggio" della parola latina, che significa "raggio". La radio è letteralmente un elemento radioso.
Otto più tardi, nel 1910, Marie Curie insieme al chimico francese André Louis Debierne, riuscì a isolare il raggio nella loro forma metallica mediante elettrolisi RACL2 usando mercurio. La febbre della ricerca è nata, che in seguito è diventata una allarmante sensazione commerciale, culturale e medicinale.
[TOC]
Struttura
La radio è un metallo i cui atomi sono molto ingombranti. Una conseguenza di ciò è che i loro cristalli sono pochi densi (anche se leggermente più di quelli di Bario) e adottano una struttura cubica centrata sul corpo (BCC). Da questa struttura, nessun altro alotropo è riportato ad altre temperature o pressioni.
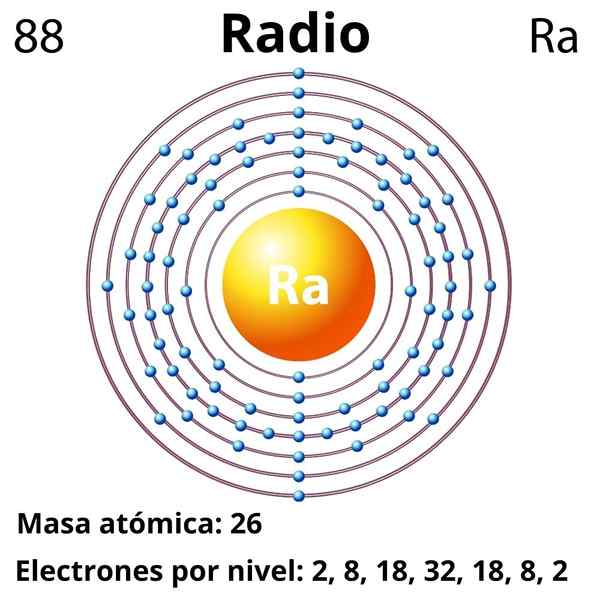
Configurazione elettronica

La configurazione elettronica per la radio è la seguente:
[RN] 7s2
Si ossida con enorme facilità per diventare il cation ra2+, che è isolectronic a nobile radon gas. Pertanto, tutti i composti del raggio contengono il cation ra2+, stabilire interazioni prevalentemente ioniche; Tuttavia, si stima che sia possibile che, a causa di effetti relativistici, possa formare collegamenti con un carattere covalente notevole (RA-X).
Può servirti: benzoato di potassio: struttura, proprietà, ottenimento, usiProprietà radio
 Campione composto radio
Campione composto radio Aspetto fisico
La radio è un metallo bianco argento, che tinge immediatamente il giallo e si oscura quando reagisce con l'azoto dall'aria per formare il suo nitruro, RA3N2. Per essere così difficile da manipolare, ci sono poche caratteristiche fisiche del raggio che sono state determinate direttamente.
Numero atomico
88
Massa molare
226.03 g/mol
Punto di fusione
Circa 700 ºC. Questa grandezza non è stata in grado di essere determinata esattamente.
Punto di ebollizione
La radio bolle tra 1100 e 1700 ºC. Questo grande margine di inesattezza riflette, ancora una volta, le complicazioni della manipolazione di un metallo così instabile.
Densità
5.5 g/cm3
Calore di fusione
8.5 kJ/mol
Calore di vaporizzazione
113 kj/mol
Stato di ossidazione
La radio ha un singolo stato di ossidazione di +2.
Elettronegatività
0.9. Questo valore corrisponde fedelmente al forte carattere elettropositivo del raggio.
Energie di ionizzazione
Primo: 509.3 kJ/mol
Secondo: 979 kJ/mol
Radioattività
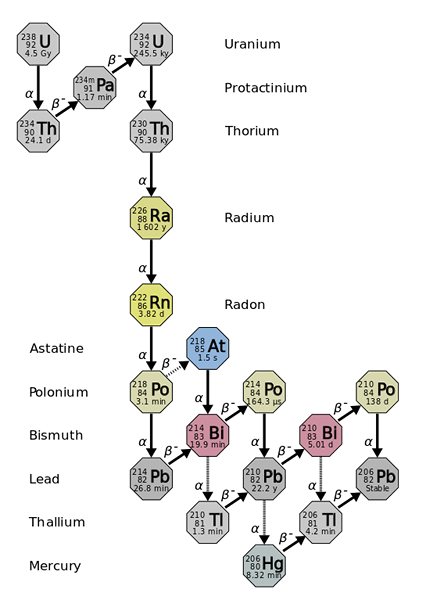 Il raggio deriva dal calo radioattivo di elementi più pesanti e più instabili, come con l'isotopo uranio-238. Fonte: Utente: Tosaka, CC di 3.0, via Wikimedia Commons
Il raggio deriva dal calo radioattivo di elementi più pesanti e più instabili, come con l'isotopo uranio-238. Fonte: Utente: Tosaka, CC di 3.0, via Wikimedia Commons Il raggio è circa un milione di volte più radioattivo dell'uranio. Ciò è dovuto principalmente al fatto che altri isotopi ne sono prodotti, come 222Rn (immagine superiore), che a sua volta decade emettendo particelle α per trasformare nell'isotopo 218Po. Un campione radio emette quindi grandi quantità di particelle α e β-, così come i raggi γ.
Ad esempio, un grammo di radio, soffre 3.7 · 1010 Disintegrazioni al secondo, misura che è servita a definire l'unità CI, chiamata CURIE. Questa energia è sufficiente per riscaldare un campione di 25 grammi di acqua 1 ° C all'ora.
Se si osserva la catena di decadimento, si vedrà che l'isotopo iniziale, il 238U, hai un T1/2 di 4.5 Giga anni (miliardi di anni); mentre invece, il 226RA ha a T1/2 1600 anni, che produce anche isotopi con T1/2 di pochi giorni, minuti e secondi.
La radioattività della radio e dei suoi composti è ionizzante, quindi sostanze fluorescenti, persino gli atomi circostanti, si illuminano durante la notte, diventando in grado di innescare reazioni esplosive. Questa proprietà è nota come radioluminescenza.
Composti e reattività
Quando i sali o i composti radio vengono riscaldati in un accendino, sparano una fiamma di carminio. Tali solidi sono generalmente bianchi o incolori, ma sono gialli tinti e infine oscurate a causa della radioattività degli atomi radiofonici. Se hanno impurità del bario, possono mostrare toni rosa.
Può servirti: reazione a doppia sostituzioneLa chimica della radio è molto simile a quella di Bario, come se fossero due fratelli inseparabili, Ra-Ba. Entrambi formano gli stessi sali, insolubili in acqua, con la differenza che quelli del raggio sono un po 'più insolubili. Ad esempio, Radio Solfato, Satin4, È più insolubile del solfato di bario, baso4; In effetti, è il solfato più insolubile mai conosciuto: 2.1 mg di esso si dissolve solo in 1 litro di acqua.
D'altra parte, radio idrossido, RA (OH)2, È il più solubile e di base di tutti gli idrossidi dei loro coetanei.
In soluzione, ra cationi2+, Invece di comportarsi come acidi Lewis, sono di base, poiché la loro grande dimensione lo rende impossibile per le molecole.
L'analogia chimica tra la radio e il bario ritorna su questo metallo difficile da separare, perché i suoi sali coprecipitano con quelli del bario.
Usi radio/applicazioni
Orologi luminosi
 Gli orologi luminosi e fosforescenti erano molto desiderati nel diciannovesimo secolo, per la loro attrattiva visiva e per contenere l'acclamata radio nei loro dipinti. Fonte: Arma95, CC BY-SA 3.0, via Wikimedia Commons
Gli orologi luminosi e fosforescenti erano molto desiderati nel diciannovesimo secolo, per la loro attrattiva visiva e per contenere l'acclamata radio nei loro dipinti. Fonte: Arma95, CC BY-SA 3.0, via Wikimedia Commons L'uso più popolare e controverso del raggio doveva essere usato come additivo per i dipinti degli orologi. I suoi atomi sono stati incorporati nelle formulazioni pastose di zinco solfuro, Zns, che hanno assorbito le emissioni radioattive per rilasciare una luce verde e fosforescente. La vernice è stata applicata alle mani dell'orologio (immagine superiore).
Il problema di questo uso era nella continua esposizione radioattiva che ha interessato gli utenti di questi orologi; O peggio, per i lavoratori che li hanno dipinti nelle fabbriche.
Nel 1924, diversi impiegati che lavoravano in un'industria della vernice, in seguito conosciute come Radio Girls (RADIUM GIRLS), iniziarono a soffrire di cancro alle ossa, deformazioni delle loro mascelle e perdite dei denti, perché dovevano leccare la punta dai tuoi pennelli per essere in grado di applicare la vernice radioattiva su orologi.
Questo, più l'ignoranza del raggio, e la piccola etica di non imporre misure di protezione che garantivano la sicurezza dei lavoratori, si è conclusa in uno scandalo legale che ha rivoluzionato le leggi sulla sicurezza professionale.
Può servirti: affitto alogenuro: proprietà, ottenimento, esempiI dipinti radio hanno smesso di essere fabbricati nel 1960; Sebbene oggi ci siano diversi campioni da collezione che lo hanno sulle loro superfici.
Raditora
 Bottiglia di raditora esposta al National Museum of Nuclear Science and History, New Mexico. Fonte: Sam Larussa dagli Stati Uniti d'America, CC BY-SA 2.0, via Wikimedia Commons
Bottiglia di raditora esposta al National Museum of Nuclear Science and History, New Mexico. Fonte: Sam Larussa dagli Stati Uniti d'America, CC BY-SA 2.0, via Wikimedia Commons Il raditora era uno dei tanti prodotti farmaceutici e cosmetici che proclamavano l'efficienza radio per combattere un migliaio e uno malato. Conteneva una quantità radio micrometrica, che come dovrebbe curare tutte le malattie digestive ed endocrine. Tuttavia, nel 1932, dopo la morte dell'Eden Byers, uno dei suoi consumatori più ferventi, il raditore lasciò il mercato.
Radioterapia
Non tutti gli usi radio erano sensazionalisti, pseudoscientifici e senza scrupoli (o criminali). C'erano anche davvero benefici per la salute, almeno fino a un po 'di tempo. Sali radio, racl2 e Rab2, Sono usati nel trattamento del cancro, in particolare il cancro alle ossa.
L'isotopo 223RA, se confuso dagli ioni di calcio nel metabolismo, finisce per distruggere le cellule tumorali situate nell'osso.
Tuttavia, molti degli usi terapeutici del raggio sono stati sostituiti da isotopi più sicuri, economici ed efficienti, come il 60Co e 137Cs.
Ottenimento
La radio è uno degli elementi la cui produzione è scarsa: solo circa 100 grammi all'anno in tutto il mondo. Tonnellate di arancia di uranio, come il minerale di pechblenda (o uraninite) vengono elaborate seguendo il metodo Curie, che consiste nel trattamento di campioni con idrossido di sodio, acido cloridrico e carbonato di sodio, in modo che una miscela di solfati radio e bario4-Baso4.
La miscela di raso4-Baso4 Fu trasformato nei rispettivi cloruri, racl2-Bacl2, separare i cationi ra2+ tramite cristallizzazioni frazionarie e infine purificanti tecniche di cromatografia ionica. Il racl2 È ridotto dall'elettrolisi o riducendolo con alluminio metallico a 1200 ºC.
Isotopi
Tutti gli isotopi radio sono radioattivi. Quattro di loro esistono in natura come prodotti del decadimento radioattivo degli atomi di 232Th, 235U e 238O.
Questi quattro isotopi sono: 223RA (T1/2= 11.4 giorni), 224RA (T1/2= 3.64 giorni), 226RA (T1/2= 1600 anni) e 228RA (5.75 anni). Ovviamente, quasi tutti gli atomi radio sono costituiti da miscele di isotopi 226Ra e 228Ra, perché altri si disintegrano rapidamente.
Lui 226RA è il più stabile di tutti gli isotopi della radio, tutti gli altri sono troppo instabili, con T1/2 Meno di due ore.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Radio. Recuperato da: in.Wikipedia.org
- I redattori di Enyclopedia Britannica. (2020). Radio. Recuperato da: Britannica.com
- Radioattività. (S.F.). Radium: il nucleo radioattivo che ha fatto la storia. Recuperato da: radioattività.Unione Europea.com
- Cantrill, v. (2018). Le realtà del radio. Nature Chem 10, 898. doi.org/10.1038/S41557-018-0114-8
- Elsevier b.V. (2020). Radio. Scienceirect. Estratto da: ScienceDirect.com
- « Fattori di erosione del vento, tipi, conseguenze, esempi
- Geografia della penisola corsiva, paesi, flora, fauna, clima »

