Quali sono l'anodo e il catodo?

- 4704
- 881
- Rufo Longo
Lui anodo e catodo Sono i tipi di elettrodi che si trovano nelle celle elettrochimiche. Questi sono dispositivi in grado di produrre elettricità attraverso una reazione chimica. Le celle elettrochimiche più utilizzate sono le batterie.
Esistono due tipi di celle elettrochimiche, celle elettrolitiche e celle galvaniche o voltaiche. Nelle cellule elettrolitiche, la reazione chimica prodotta dall'energia non si verifica spontaneamente, ma la corrente elettrica viene trasformata in una reazione di ossidazione chimica.

La cellula galvanica è composta da due semi -ladg. Questi sono collegati da due elementi, un driver metallico e un ponte salino.
Il direttore elettrico, come indicato dal suo nome, conduce elettricità perché ha pochissima resistenza al movimento della carica elettrica. I migliori driver sono di solito metalli.
Il ponte salino è un tubo che collega i due semi -lladi, pur mantenendo il loro contatto elettrico e senza lasciare che i componenti di ogni cella si uniscano.Ogni semi -media della cella galvanica contiene un elettrodo e un elettrolita.
Quando si verifica la reazione chimica, uno dei semi -lladi perde elettroni nel suo elettrodo, attraverso il processo di ossidazione; Mentre l'altro vince elettroni per l'elettrodo, attraverso il processo di riduzione.
I processi di ossidazione sono prodotti nell'anodo e i processi di riduzione nel catodo
[TOC]
Anodo
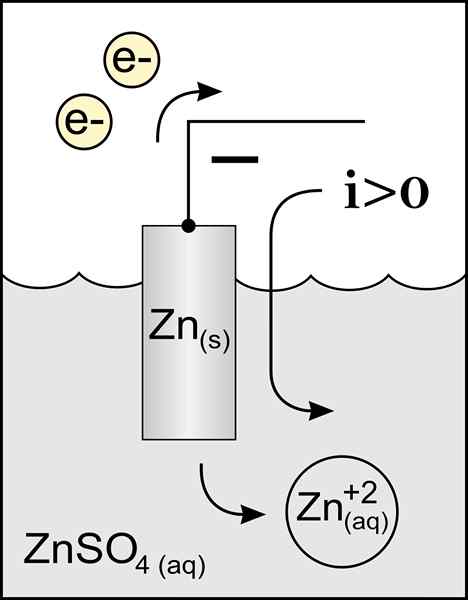 Diagramma di un anodo di zinco in una cella voltaica. Fonte: lavoro originale: file: anodo di zinco 2.PNG per utente: Micheljullian (talk) Derivative Work: KES47/CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/)
Diagramma di un anodo di zinco in una cella voltaica. Fonte: lavoro originale: file: anodo di zinco 2.PNG per utente: Micheljullian (talk) Derivative Work: KES47/CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/) Il nome dell'anodo proviene dal greco ανά (Aná): up e οδός (odós): Path. Faraday è stato colui che ha coniato questo termine nel diciannovesimo secolo.
Il miglior anodo che definisce è l'elettrodo che perde elettroni in una reazione di ossidazione. Normalmente è collegato al polo positivo del transito della corrente elettrica, ma non è sempre il caso.
Può servirti: soluzioni apprezzateSebbene nelle batterie l'anodo sia il polo positivo, nelle luci a LED è l'opposto, l'anodo è il palo negativo.
Normalmente il senso della corrente elettrica è definito, apprezzandolo come un senso di carichi liberi, ma se il driver non è metallico, le cariche positive prodotte vengono trasferite al driver esterno.
Questo movimento implica che abbiamo cariche positive e negative che si muovono in sensi opposti, quindi si dice che la direzione della corrente sia la via delle cariche positive dei cationi che si trovano nell'anodo verso il carico negativo degli anodi degli anodi che si trovano nel catodo.
Nelle cellule galvaniche, con un conduttore metallico, la corrente generata nella reazione segue il percorso dal polo positivo al negativo.
Ma nelle celle elettrolitiche, non avendo un conduttore metallico, ma si possono trovare un elettrolita, ioni con carico positivo e negativo che si muovono in sensi opposti.
Gli anodi termoionici ricevono la maggior parte degli elettroni che provengono dal catodo, riscaldano l'anodo e devono trovare un modo per dissiparsi. Questo calore viene generato nella tensione che si verifica tra gli elettroni.
Anodi speciali
Esiste un tipo di anodi speciali, come quelli all'interno di raggi X. In questi tubi, l'energia prodotta dagli elettroni, oltre a produrre raggi X, genera una grande energia che riscalda l'anodo.
Questo calore si verifica alla diversa tensione tra i due elettrodi e che esercita pressione sugli elettroni. Quando gli elettroni si muovono nella corrente elettrica, colpiscono l'anodo trasmettendo il loro calore.
Può servirti: equazione di Henderson-Haselbalch: spiegazione, esempi, esercizio fisicoCatodo
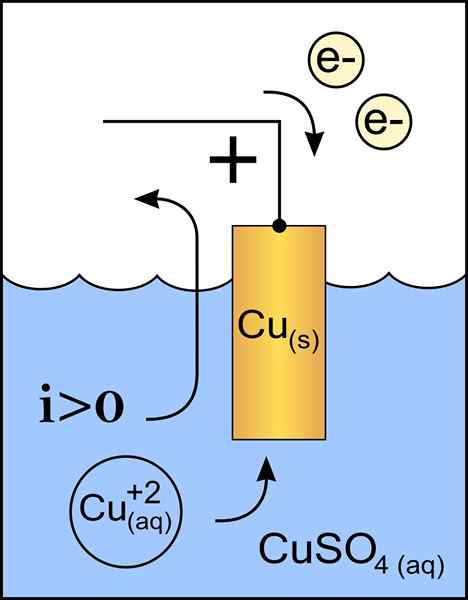 Diagramma del catodo di rame in una cella voltaica. Fonte: lavoro originale: file: anodo di zinco 2.PNG per utente: Micheljullian (talk) Derivative Work: KES47/CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/)
Diagramma del catodo di rame in una cella voltaica. Fonte: lavoro originale: file: anodo di zinco 2.PNG per utente: Micheljullian (talk) Derivative Work: KES47/CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/) Il catodo è l'elettrodo con carico negativo, che nella reazione chimica subisce una reazione di riduzione, in cui il suo stato di ossidazione è ridotto quando riceve elettroni.
Come per l'anodo, è stato Faraday a suggerire il termine catodo che proviene dal greco κατά [Catá]: "Down" e ὁΔός [Odós]: "Road". A questo elettrodo, il carico negativo è stato attribuito nel tempo.
Questo approccio era falso, poiché a seconda del dispositivo in cui si trova, ha un carico o un altro.
Questa relazione con il polo negativo, come con l'anodo, deriva dal presupposto che la corrente fluisca dal polo positivo al negativo. Questo sorge all'interno di una cellula galvanica.
All'interno delle cellule elettrolitiche, i mezzi di trasferimento di energia, in quanto non si trova in un metallo ma in un elettrolita, possono coesistere ioni negativi e positivi che si muovono in sensi opposti. Ma per accordo, si dice che la corrente va dall'anodo al catodo.
Catodi speciali
Un tipo di catodi specifici sono catodi termionici. In questi, il catodo emette elettroni a causa dell'effetto del calore.
Nelle valvole termioniche, il catodo può riscaldarsi circolando una corrente di riscaldamento in un filamento che lo ha accoppiato ad esso.
Reazione di equilibrio
Se prendiamo una cella galvanica, che è la cella elettrochimica più comune, possiamo formulare la reazione di equilibrio che viene generata.
Ogni semi -media che forma la cellula galvanica, ha una tensione caratteristica nota come potenziale di riduzione. All'interno di ogni semi -media c'è una reazione di ossidazione tra i diversi ioni.
Può servirti: spettro di assorbimentoQuando questa reazione raggiunge un equilibrio, la cella non può fornire più tensione. In questo momento, l'ossidazione che si sta verificando nel semi -media di quel momento avrà un valore positivo che più è il bilanciamento. Il potenziale della reazione sarà maggiore, più equilibrio viene raggiunto.
Quando l'anodo è in equilibrio, inizia a perdere elettroni che passano attraverso il driver al catodo.
Nel catodo si sta verificando la reazione di riduzione, più il più potenziale equilibrio avrà la reazione quando si producono e prendono gli elettroni che provengono dall'anodo.
Riferimenti
- Huheey, James e., et al.Chimica inorganica: principi di struttura e reattività. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Chimica: principi e proprietà. New York, USA: McGraw-Hill, 1966.
- Brady, James e.Chimica generale: principi e struttura. Wiley, 1990.
- Petrucci, Ralph H., et al.Chimica generale. Inter -American Educational Fund, 1977.
- Masterton, William L.; Hurley, Cecile N.Chimica: principi e reazioni. Cengage Learning, 2015.
- Charlot, Gaston; Tremollon, Bernard; Badoz-Lombling, J. Reazioni elettrochimiche. Toray-Masson, 1969.
- « I 10 contributi e invenzioni più importanti
- Caratteristiche del quetzal, habitat, riproduzione, cibo »

