Cos'è la periodicità chimica?
- 3726
- 587
- Lidia Valentini
IL Periodicità chimica È una tendenza o un modello che mostra gli elementi chimici per una serie di proprietà chimiche e fisiche. Diventa una sorta di parentela, che era una guida fondamentale per i genitori di chimica organizzare e classificare tutti gli elementi nella tavola periodica conosciuta di oggi.
Gli 118 elementi esistenti (tra naturale e artificiale) mantengono, in misura diversa, una relazione reciproca che li definisce in famiglie o gruppi. Inizialmente ciò consentiva di descrivere le reattività degli elementi, nonché il tipo di composti che si formano; E ancora meglio, prevedi le proprietà di coloro che non erano ancora stati scoperti.
 Gli elementi della tavola periodica
Gli elementi della tavola periodica Quindi, mentre il ventesimo secolo e la fisica progredivano, queste proprietà erano correlate alla struttura elettronica dell'atomo. Pertanto, gli elettroni segnano la periodicità chimica nei confronti degli elementi, ma non tanto per i loro isotopi e la stabilità relativa.
Grazie alla periodicità chimica è possibile capire perché gli elementi sono posizionati nello stesso gruppo nella tavola periodica. Abilita anche la previsione di proprietà chimiche e persino fisica, tra elementi di diverse masse atomiche.
[TOC]
Schemi e gruppi
 Come i modelli di zigzaging di queste nuvole, le proprietà degli elementi mostrano una tendenza periodica e caratteristica. Fonte: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Come i modelli di zigzaging di queste nuvole, le proprietà degli elementi mostrano una tendenza periodica e caratteristica. Fonte: Pravin Bagga/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) Si osserva la periodicità chimica, come previsto, nelle proprietà periodiche. Questi sono caratterizzati dalla tendenza dei loro valori in quanto vengono valutati per un periodo o un gruppo periodici.
È possibile scegliere uno zigzag, una sega o una montagna ripida per scopi di confronto: con alti e bassi. Cioè, intervallo di proprietà periodiche con minimo e massimo per alcuni elementi. E le posizioni relative di questi elementi corrispondono, brillantemente, con la posizione nei rispettivi gruppi.
Ecco perché la periodicità chimica è utile per analizzarlo in base ai gruppi; Tuttavia, i periodi sono essenziali per una visione completa della tendenza.
Può servirti: carbonato di potassio (K2CO3): struttura, proprietà, usi, ottenimentoSi vedrà con i seguenti esempi di periodicità in chimica, che non solo guadagnano nelle proprietà periodiche, ma anche nei composti inorganici e, inclusivi, organici.
Energia ionizzata
L'energia di ionizzazione, è, è una delle proprietà periodiche più eccezionali. Più grande è l'atomo di un elemento, più facile uno dei suoi ultimi elettroni sarà rimuovere; cioè quelli di Valencia. Pertanto: gli atomi con piccole radio avranno grandi, mentre gli atomi con grandi radio, avranno piccoli.
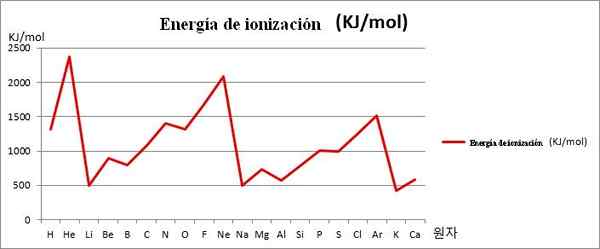 EI vs. grafica. I primi 20 elementi chimici. Fonte: Kenneth.JH.Han/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)
EI vs. grafica. I primi 20 elementi chimici. Fonte: Kenneth.JH.Han/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) Nota ad esempio nell'immagine sopra che gli elementi Li, Na e K, hanno i minori EI, motivo per cui si trovano nelle vallate o nei fondi della grafica. Nel frattempo, gli elementi che lui, NE e AR, si trovano sui vertici o sui punti superiori, poiché i loro sono molto grandi in relazione agli altri elementi.
Gli elementi Li, Na e K appartengono al gruppo di metalli alcalini, caratterizzati dalle loro vittime EI. D'altra parte, gli elementi che lui, NE e AR corrispondono ai gas nobili, con molto alti, perché i loro atomi sono i più piccoli tra tutti gli elementi per lo stesso periodo della tavola periodica.
Pertanto, la periodicità chimica indica che diminuisce un gruppo, ma aumenta il tour di un periodo da sinistra a destra.
Blocca Hydros P
Un esempio della periodicità chimica al di fuori delle proprietà periodiche che vediamo negli idrori degli elementi di blocco P.
Ad esempio, il gruppo 15 è composto da elementi N, P, AS, SB e BI. Se si sa che l'ammoniaca, NH3, Ha l'azoto con un numero di ossidazione di +3, quindi è possibile prevedere, con una semplice periodicità, che gli elementi rimanenti hanno anche idroli simili. E in effetti lo è: NH3, Ph3, Cenere3, Sbh3 e Bih3.
Può servirti: boro: storia, proprietà, struttura, usiUn altro caso simile si verifica con il gruppo 16. L'idruro di ossigeno è h2O, acqua. Si prevede, ancora una volta, che gli elementi S, SE, TE e PO abbiano idrori con formule uguali, ma con proprietà abissalmente diverse. E questo è: h2Sh2Se, h2Te e h2Po. Ciò è dovuto alla periodicità chimica.
Forse l'esempio più impressionante è compreso dal carbonio, dal silicio e dall'idros. L'idruro di carbonio è Cho4, E quello del silicio, Sih4. Il Germanio, previsto da Mendeleev con il nome di Eka-Silicio (ES), deve avere come periodicità un idruro con formula GEH4; Previsione che è finita per confermare dopo la sua scoperta e gli studi successivi.
Molecole alogene
Se è noto che il fluoro è in stato elementare come molecola m2, Quindi si presume che gli altri alogeni (Cl, Br, I e AT) formano anche molecole diatomiche. E cioè, essendo le molecole di Cl2, Br2 e io2 Il più conosciuto.
Ossidi e solfuri
Allo stesso modo, come menzionato con gli idrori a blocchi P, Gli ossidi e i solfuri per elementi dello stesso gruppo mostrano una sorta di corrispondenza nelle rispettive formule chimiche. Ad esempio, l'ossido di litio è li2Oppure, essendo ossidi per altri metalli alcalini o gruppo 1: NA2VA BENE2O, Rb2O e CS2O.
Questo perché in tutti questi i metalli con un numero di ossidazione di +1, interagiscono con un anione o2-. Lo stesso accade con i loro solfuri: li2S, na2S, ecc. Nel caso di metalli alcalinotherro o gruppo 2, le formule dei loro ossidi e solfuri sono, rispettivamente: Bee and Bes, MGO e MGS, CAO e CAS, SRO e SRS, BaO e BAS.
Può servirti: acido selenario (H2SO3): proprietà, rischi e usiQuesta periodicità si applica anche (in parte) per gli ossidi degli elementi di blocco P: Co2, Sio2, Geo2, B2O3, Al2O3, Ga2O3, eccetera. Tuttavia, per gli elementi a blocchi D o altri del blocco P, Questa periodicità diventa più complicata a causa dei più alti numeri di ossidazione per lo stesso elemento.
Ad esempio, il rame e l'argento appartengono al gruppo 11. Uno ha due ossidi: CUO (Cu2+) e cu2O (Cu+); Mentre l'altro ha a malapena solo uno: fa (AG+).
Idrocarburi e silani
Sia il carbonio che il silicio hanno la capacità di formare rispettivamente legami C-C o Si-SI. I legami C-C sono molto più stabili, quindi le strutture di idrocarburi possono diventare sproporzionatamente più numerose e varie di quelle delle loro controparti di Siltan.
Questa conclusione è di nuovo dovuta alla periodicità chimica. Ad esempio, Ethana, Cho3Cap3 o c2H6 Il Duilanum ha la sua controparte, Sih3si3 o se2H6.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Helmestine, Anne Marie, PH.D. (26 agosto 2020). Definizione pererodia in chimica. Recuperato da: Thoughtco.com
- E. V. Babaev e Ray Hefferlin. (S.F.). Concetto di periodicità chimica:
Dal tavolo molecolare mendeleev modelli di iper-periodicità. Recuperato da: Chem.MSU.Ru - Fiori p., Theopold k., & Langley r. (S.F.). Periodia. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- L'università aperta. (2020). I modelli chimici si trovano nella tabella del periodo: periodicità chimica. Recuperato da: aperto.Edu
- « Concetto di equilibrio stabile ed esempi
- Storia della sociologia rurale, campo di studio, importanza »

