Caratteristiche della proteinasi K, attività enzimatica, applicazioni
- 4339
- 184
- Dante Morelli
IL Proteina k È un enzima che appartiene al gruppo di proteasi serine, cioè nel suo centro catalitico attivo un aminoacido serina e ha la funzione di rompere i legami peptidici mediante idrolisi. A sua volta, questo enzima appartiene alla famiglia delle proteine della subtilisina (Peptidasi S8).
La K proteinasi ha un peso molecolare (PM) di 28.900 Daltons ed è stato isolato per la prima volta in 1.974 negli estratti di funghi Album Engyodontium, precedentemente noto come il nome di Album Tritirachium Limber.
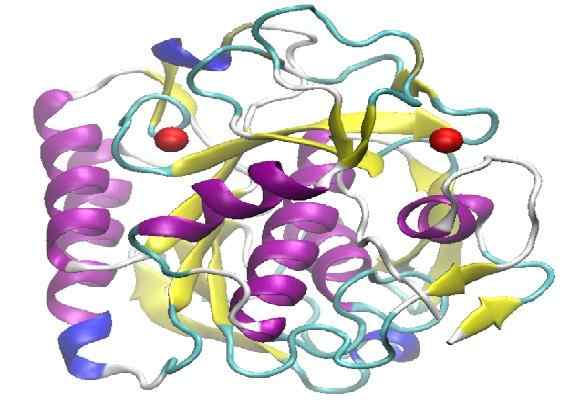
 Struttura molecolare della K proteinasi. Fonte: Lykchiniadis [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Struttura molecolare della K proteinasi. Fonte: Lykchiniadis [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Presenta un'alta capacità proteolitica, dimostrata per essere in grado di degradare la cheratina presente nei capelli. La parola cheratina in inglese è scritta "cheratina", da lì arriva che è stata chiamata "ProteinSa K".
A causa della sua alta potenza di dividere le proteine native, questo enzima è utile in varie tecniche di biologia molecolare. Utilizzato principalmente per isolare e preparare gli acidi nucleici con alto peso molecolare (PM).
La K proteinasi agisce rilasciando il DNA nucleare, distruggendo le proteine e inattive a RNasi e DNATE, cioè elimina le nuclei nei preparativi del DNA e dell'RNA.
D'altra parte, è stato visto che K proteinasi può idrolizzare alcune proteine native denaturate, il che ha reso l'interesse dei ricercatori per l'uso nello studio delle proteine del prione (PRPC).
Tuttavia, nonostante il suo alto potere proteolitico, ci sono proteine resistenti all'azione della proteina K. Tra questi, ci sono alcune proteine anomale chiamate Prioni (PRPSC), associate a encefalopatie spongiformi trasmissibili.
[TOC]
Caratteristiche della proteinasi K
La K proteinasi ha una struttura terziaria costituita da tre strati, con un foglio β di sette catene mediche tra due strati di eliche. L'appartenenza alla famiglia delle peptidasi S8 è caratterizzata dalla presentazione di una triade catalitica nel suo sito attivo, il cui ordine sequenziale è (ASP, suo e essere), che li differenzia dalle altre famiglie di peptidasi.
Può servirti: aminoacidi proteiciQuesto enzima del gruppo di proteasi serina è caratterizzato da legami peptidici idrolizzanti vicino al gruppo carbossilico di aminoacidi alifatici e aromatici.
D'altra parte, è in grado di agire in presenza di alcune sostanze corrosive, come il dodecilsulfato di sodio (SDS), Tris-HCl ed EDTA, che sono usati per aiutare la denaturazione delle proteine, facendo perdere loro la loro struttura nativa.
Questo è un passo precedente nella preparazione di proteine per la tecnica dell'elettroforesi. L'intervallo di pH a cui agisce la proteina K è piuttosto ampia (2.Da 0 a 12.0), con un pH ottimale tra 7.5 a 12.0, e il suo punto isoelettrico è 8.9. Come si può vedere, è attivo contro una gamma molto ampia di pH.
Un'altra caratteristica che si distingue nella K proteinasi è la sua stabilità in presenza di alte temperature (50 - 60 ° C).
Attività enzimatica
La K proteinsa ha bisogno della presenza di ioni di calcio, sebbene non influisca sulla sua attività, se è essenziale mantenerne la stabilità.
Affinché la K proteinsa esegui la completa digestione del substrato, è necessario un tempo di contatto approssimativo tra 5 minuti fino a 2 ore.
Tuttavia, in questo senso Daza e collaboratori hanno confrontato la purezza del DNA ottenuto in diversi tempi di esposizione contro la K proteinasi e hanno concluso che un'incubazione prolungata (fino a 24 ore) migliora significativamente la qualità del DNA.
Ora, in relazione alla concentrazione utilizzata dell'enzima K proteinasi nei diversi protocolli, si può dire che è molto vario.
Può essere utilizzato da concentrazioni molto basse (5 µg/mL) a 500 µg/ml di concentrazioni. Ma le concentrazioni di lavoro più frequenti vanno tra 50-100μg /ml, in particolare per la digestione delle proteine e le nuclei. Sebbene per il trattamento tissutale è richiesta una concentrazione di 2 mg/ml.
Può servirti: Easmotherium sibiricum: caratteristiche, habitat, fossiliApplicazioni
Le loro applicazioni sono molto ampie e possono essere riassunte nel seguente:
-È usato nella digestione delle proteine e nell'estrazione del DNA con diversi metodi come: salting-out, PK-SDS, cetil-tritetil ammonio (CTAB), acetato di potassio modificato e estrazione di ioduro di sodio acetate.
-Inattivazione di Nucleasas (RNASA e DNASAS).
-Nella tecnica di ibridazione Sul posto (Il suo), per aiutare il rilascio di acido nucleico, oltre a eliminare le proteine indesiderabili.
-Modifica delle proteine.
-A livello di ricerca, in vari studi.
Vantaggi di K proteinasi
Sono stati condotti vari studi comparativi tra tecniche di estrazione del DNA che usano la proteinasi K, con altri che non la usano e tutti concludono che ci sono maggiori benefici quando viene utilizzato l'enzima. Tra i vantaggi, si può menzionare quanto segue:
-Si ottiene DNA di alta molecolare, di alta qualità e purezza.
-Il DNA estratto è stabile per un massimo di 3 mesi.
Il DNA estratto può essere utilizzato nelle seguenti tecniche: Southern blot, reazione a catena della polimerasi (PCR), elettroforesi, tra gli altri.
Proteine k resistenti alla proteinasi
Varie indagini hanno concluso che i prioni (proteine anomali PRPSC tossiche differiscono dalle proteine PRPC (native) essendo resistenti all'azione di K proteinasi, mentre i PRPC sono sensibili alla loro azione.
Altri autori hanno descritto che nella struttura di PRPSC ci sono porzioni sensibili e altri resistenti alla K proteinasi. Tuttavia, entrambe le parti sono ugualmente tossiche e contagiose.
D'altra parte, Bastian e collaboratori nel 1987 hanno isolato 4 proteine di 28, 30, 66 e 76 kDa da una specie di Spiroplasma Mirum. Tutti si sono rivelati resistenti all'azione della K proteinasi e hanno anche avuto una reazione incrociata con alcuni prioni.
Può servirti: chemiotossisÈ noto che questa specie può causare importanti cataratte e danni neurologici e a causa dei risultati scientifici di Bastian, tra le altre ricerche, ha cercato di relazionarsi con questo microrganismo con encefalopatie spongiformi trasmissibili trasmissibili.
Tuttavia, l'eziologia di questa patologia neurologica degenerativa rimane attualmente attribuita ai prioni.
In questo senso, Butler e collaboratori nel 1991 hanno identificato e caratterizzato una classe di una proteinasi KDA da 40 kDa, resistente a due ceppi da due ceppi di Mycoplasma Hyorhinis. Questo patogeno colpisce i suini, infettando i loro tessuti, ma in questo caso non vi è stata alcuna reazione incrociata con le carceri testate.
Sono necessarie ulteriori ricerche per chiarire molte incognite al riguardo.
Riferimenti
- Bastian F, Jennings R e Gardner W. 1987. Antisiero a proteina fibrilla ad asocie-react con la proteina fibri Spiroplasma MiruM Proteine fibrilla. J. Clin. Microbiol. 25: 2430-2431.
- Daza C, Guillen J, King J, Ruiz V. Valutazione di un metodo di estrazione e purificazione del DNA dal tessuto muscolare fisso nella formaldeide dei cadaveri non identificati. Med, 2014; 22 (1): 42-49,
- Butler G, Kotani H, Kong L, Frick M, Evancho S, Stanbridge E e McGarrity G. Identificazione e caratterizzazione delle proteine resistenti alla proteina K nei membri della classe Mollicutes. Infection and Immunità, 1991, 59 (3): 1037-1042
- López M, Rivera M, Viettri M, Lares M, Morocoima A, Herrera L, et al. Confronto di due protocolli di estrazione del DNA di Trypanosoma cruzi coltivato nel mezzo axhenic. Rev. Perù. Med. Exp. Salute pubblica 2014; 31 (2): 222-227. Disponibile su: scielo.org
- Jiménez G, Villalobos M, Jiménez E e Palma W. Determinazione dell'efficacia di cinque protocolli di estrazione del DNA dal materiale parafino per studi molecolari. Rev Méd Medic Costa Rica. 2007; 1 (1): 10-19.
- « Flora e fauna di Santiago Del Estero Specie principali
- Storia di obsolescenza programmata, tipi, conseguenze »

