Struttura chimica di Pencanona, proprietà, sintesi, usi
- 1929
- 4
- Brigitta Ferrari
IL Pentanona È un composto organico, appartenente alla famiglia dei chetoni, la cui formula chimica è C5H10O. Rimane uno dei chetoni più semplici ed è costituito da un liquido incolore con un aroma simile a quello dell'acetone. Da ora in poi, rispetto al numero di carbonio del loro scheletro, i chetoni presentano l'isomero.
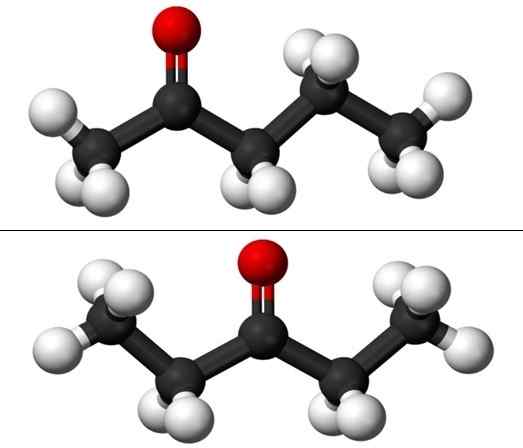
Quando si parla di posizione Isomeria si riferisce a dove si trova il gruppo carbonile, c = o. Pertanto, Puntanona in realtà è costituita da due composti con proprietà fisiche che differiscono a malapena l'una dall'altra: 2-penone e 3-penone (IMMAGINE inferiore). Entrambi sono liquidi, ma i loro punti di ebollizione sono gli stessi, quindi non possono essere separati dalla distillazione.
 Molecole della posizione isomeri per Pentanona. Fonte: Jynto & Ben Mills via Wikipedia.
Molecole della posizione isomeri per Pentanona. Fonte: Jynto & Ben Mills via Wikipedia. Tuttavia, ciascuno dei due pentanoni ha la sua via di sintesi, quindi è improbabile che ci sia una miscela; miscela che può essere fattibile per separare il congelamento.
I suoi usi sono limitati soprattutto come solventi organici; Alternative all'acetone nei media in cui lavori con una temperatura superiore al suo basso punto di ebollizione. Stanno anche iniziando materiali per altre sintesi organiche, poiché il loro gruppo C = O può ridurre o subire l'aggiunta nucleofila.
[TOC]
Struttura chimica
Posizione isomeri
Nell'immagine abbiamo le strutture molecolari degli isomeri a due posizioni per la Puntanona, rappresentata da un modello di sfere e barre. Le sfere nere corrispondono agli scheletri carbonizzati, agli atomi di idrogeno e agli atomi di ossigeno rosso nel gruppo C = O.
2-Pintanone
La 2-Ponanona (sopra) ha il gruppo C = o nel secondo carbonio, che equivale a se fosse nella stanza; Cioè, la 2-Ponanona e la 4-Pantanona sono equivalenti, poiché è sufficiente ruotarli 180º in modo che le loro strutture siano le stesse.
Può servirti: tetracloruro di carbonio (CCL4)A sinistra di c = o hai un radicale metilico, Cho3-, E alla sua destra, un propil radicale. Ecco perché questa Cetona riceve anche il nome (meno usato) da Metil Propil Cetona (MPK in inglese). Puoi vedere l'asimmetria di questa struttura a prima vista.
3-penone
Il 3-Péntanona (sotto) ha il gruppo C = O nella terza carbonio. Si noti che questo isomero è una versione più grande di acetone e che è anche molto simmetrico; I due radicali ai lati del gruppo C = O sono uguali: due radicali etilici, CH3Cap2-. Ecco perché la 3-Pananona è anche chiamata Cetona diesiel (o dimetil acetone).
Interazioni intermolecolari
La presenza del gruppo carbonilico, sia nel 2-Pantanone che nella 3-Penona, conferisce polarità alla molecola.
Pertanto, entrambi gli isomeri di Pentanona sono in grado di interagire tra loro attraverso il dipolo-dipol.
Allo stesso modo, le forze di dispersione di Londra tra scheletri di carbonio e idrogenati intervengono in misura minore.
Avendo la Puntanona, un'area molecolare e una massa più ampia rispetto a quelle dell'acetone, questo contributo si aggiunge al suo momento di dipolo e consente a un punto di ebollizione più elevato (102 ºC> 56 ºC) per possedere un punto di ebollizione più alto). In effetti, i due isomeri vaporizzano a 102 ºC; mentre si congelano a temperature diverse.
Cristalli
Probabilmente nella cristallizzazione le simmetrie svolgono un ruolo importante. Ad esempio, il punto di fusione del 2 -Pantanona è -78 ºC, mentre il 3 -péntanona, -39 ºC.
Può servirti: legge AvogadroCiò significa che i cristalli a 3-Pantanona sono più stabili contro la temperatura; Le sue molecole sono più coerenti e richiedono più calore per separarsi in fase liquida.
Se ci fossero una miscela di entrambi gli isomeri, il 3-penone sarebbe il primo a cristallizzarsi, essendo infine la 2-pananona a una temperatura inferiore. Le molecole del 3-Pantanone, più simmetriche, sono orientate più facilmente di quelle di 2-Ponanona: asimmetriche e allo stesso tempo più dinamiche.
Proprietà
Aspetto fisico
Liquidi incolori con un aroma simile a quello dell'acetone.
Massa molare
86,13 g/mol
Densità
0,81 g/ml (3-Ponanona)
0,809 g/ml (2-Ponanona)
Punto di fusione
-78 ºC (2-Ponanona)
-39 ºC (3-Ponanona)
Punto di ebollizione
102 ºC (per entrambi gli isomeri)
Solubilità dell'acqua
35 g/L (3-Ponenona)
60 g/L (2-Ponenona)
Pressione del vapore
35 mmHg (3-Ponenona)
270 mmHg (2-Pantanone) a 20 ºC
Questi valori non sono utili per confrontare direttamente le pressioni del vapore di entrambi gli isomeri, poiché il primo è riportato senza la temperatura alla quale è stato misurato.
punto d'infiammabilità
12,78 ºC (3-Ponanona)
10 ºC (2-Ponanona)
Stabilità
I due isomeri di Pentanona sono estremamente infiammabili, quindi devono rimanere lontano da qualsiasi fonte di calore. I punti flash indicano che una fiamma può impostare i vapori di entrambe le pentana anche a una temperatura di 10 ºC.
Sintesi
Sebbene i due isomeri di Pentanona siano fisicamente e chimicamente molto simili, le loro rotte sintetiche sono indipendenti dall'altra, quindi è improbabile che entrambi siano ottenuti nella stessa sintesi.
2-Pintanone
A partire dal reagente a 2-penol, un alcool secondario, questo può essere ossidato a 2-ponone usando acido ipocloroso formato in situ, HCLO, come agente ossidante. L'ossidazione sarebbe:
Può servirti: nessun elettroliti: caratteristiche ed esempi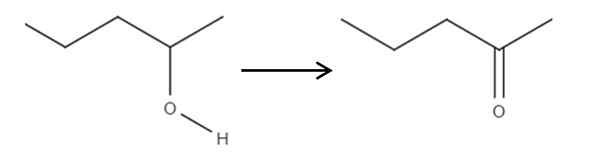 Ossidazione di 2-Pantanolo a 2-Pantanona. Fonte: Gabriel Bolívar.
Ossidazione di 2-Pantanolo a 2-Pantanona. Fonte: Gabriel Bolívar. Semplicemente il collegamento c-oh diventa c = o. Esistono altri metodi per sintetizzare la 2-Penona, ma questo è il più semplice da capire.
3-penone
Il 3-ptanone può essere sintetizzato per mezzo3Cap2COOH. Questa via sintetica produce chetoni simmetrici ed è una molecola CHO3COOH perderà il gruppo COOH sotto forma di CO2, Mentre l'altro il tuo gruppo oh sotto forma di h2O:
2ch3Cap2COOH => CH3Cap2Coch2Cap3 + Co2 + H2O
Un altro percorso leggermente più complesso è reagire direttamente una miscela di etilene, Cho2= Ch2, Co2 e h2 Per formare la 3-Ponanona.
Applicazioni
A meno che l'applicazione non sia molto rigorosa, è una sintesi specifica o che è stato anche dimostrato che i due isomeri non causano gli stessi risultati, è irrilevante scegliere tra l'uso del 2-penone o 3-Penone in nessuno dei suoi usi.
Cioè, "non importa" se si desidera utilizzare la 2-Ponanona o 3-Penona come solvente di dipinti o resine, o come miserabile, perché i criteri più importanti diventeranno il suo prezzo e la sua disponibilità. Il 3 penone viene utilizzato nell'industria automobilistica per studiare il comportamento dei gas all'interno dei motori a combustione interna.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Wikipedia. (2019). 3-pion. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). 2-Pontenone. Database PubChem. CID = 7895. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Royal Society of Chemistry. (2019). 3-pion. Recuperato da: Chemspider.com
- Professore T. Nalli. (2013). Ossidazione di 2-pintanolo e distillazione del prodotto. Recuperato da: Corso1.Winona.Edu

