Oxácido

- 2857
- 490
- Brigitta Ferrari
 Molecola di acido pertettaletico, un oxo acido molto raro di Tecnecio. Fonte: Jynto, Wikimedia Commons
Molecola di acido pertettaletico, un oxo acido molto raro di Tecnecio. Fonte: Jynto, Wikimedia Commons Cos'è un oxacid?
UN oxácido, U oxoacid, è un acido che contiene ossigeno. È composto da idrogeno, ossigeno e un elemento non metallico che costituisce l'atomo centrale così chiamato. A seconda del numero di atomi di ossigeno, e quindi, gli stati di ossidazione dell'elemento non metallico possono formare diversi ossacidi.
Gli oxcacidi hanno un gran numero di usi, che sono difficili da descrivere in generale. La sua applicazione dipenderà notevolmente dall'atomo centrale e dal numero di ossigeno.
Possono servire dai composti per la sintesi di materiali, fertilizzanti ed esplosivi, anche per scopi analitici o produzione di bevande analcoliche, come si verifica con acido carbonico e acido fosforico, H3Po4, essere parte della composizione di queste bevande.
Caratteristiche e proprietà di Oxcacid
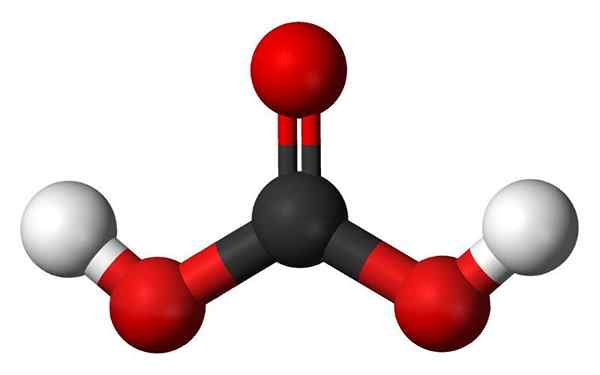 Molecola di acido carbonico. Fonte: Jynto e Ben Mills, Wikimedia Commons
Molecola di acido carbonico. Fonte: Jynto e Ben Mills, Wikimedia Commons - Gruppi idrossilici: Una delle caratteristiche principali di un oxácido non è solo che ha ossigeno, ma anche questo è come un gruppo OH. D'altra parte, alcuni oxacidi hanno quello che viene chiamato un gruppo Oxo, E = O. Nel caso dell'acido fosforo, ha un gruppo Oxo, p = O. Mancano gli atomi H, quindi "non sono responsabili" per l'acidità.
- Atomo centrale: L'atomo centrale (E) può o meno essere un elemento elettronegativo, a seconda della sua posizione nel blocco P della tabella periodica. D'altra parte, l'ossigeno, un elemento leggermente più elettronegativo rispetto all'azoto, attira gli elettroni del legame OH, permettendo così il rilascio di ioni H+. E è quindi collegato a gruppi OH. Quando viene rilasciato uno ione H+ si verifica la ionizzazione acida, cioè acquisisce una carica elettrica, che nel suo caso è negativa. Un oxcacid può rilasciare così tanti ioni H+ Come i gruppi OH hanno nella sua struttura, e più ci sono, maggiore sarà il carico negativo.
- Forza acida: La forza di quasi tutti gli ossacidi che hanno lo stesso atomo centrale (nessun metallo), aumenta con l'aumento dello stato di ossidazione dell'elemento centrale, che a sua volta è direttamente correlato all'aumento del numero di atomi di ossigeno.
Ad esempio, sono mostrate tre serie di ossacidi le cui forze di acidità sono ordinate dal meno al massimo:
H2SW3 < H2SW4
Hno2 < HNO3
HCLO < HClO2 < HClO3 < HClO4
Nella maggior parte degli oxacidi che hanno elementi diversi con lo stesso stato di ossidazione, ma appartenenti allo stesso gruppo della tavola periodica, la forza di acidità aumenta direttamente con l'elettronegatività dell'atomo centrale:
H2Seo3 < H2SW3
H3Po4 < HNO3
HBRO4 < HClO4
Formazione di Oxcacid
Come menzionato all'inizio, gli oxácidos vengono generati quando alcune sostanze, chiamate ossidi acidi, reagiscono con l'acqua. Questo sarà spiegato usando lo stesso esempio di acido carbonico.
CO₂+H₂O H2Co3
Ossido acido + acqua => oxácido
Quello che succede è che la molecola di H₂O si lega covalentemente con quella di CO₂. Se l'acqua viene eliminata dal calore, l'equilibrio per la rigenerazione delle mosse di CO₂, cioè una bevanda calda di soda perderà presto la sua sensazione effervescente di un freddo.
D'altra parte, gli ossidi acidi si formano quando un elemento non metallico reagisce con l'acqua, sebbene, più precisamente, quando l'elemento reagente forma un ossido con un carattere covalente, la cui soluzione in acqua genera onori ioni H+.
È già stato detto che gli ioni H+ Sono il prodotto della risultante ionizzazione oxacidica.
Esempi di addestramento
L'ossido clorico, CL2O5, Reagire con l'acqua per dare l'acido clorico:
Cl2O5 + H₂o => hclo3
Ossido solforico, così3, Reagisce con l'acqua per formare acido solforico:
SW3 + H₂o => h2SW4
E l'ossido periódic, io2O7, reagisce con l'acqua per formare l'acido periódic:
Yo2O7 + H₂o => hio4
Oltre a questi meccanismi classici per la formazione di ossacidi, ci sono altre reazioni per lo stesso scopo.
Può servirti: reazione endotermicaAd esempio, fosforo tricloruro, PCL3, Reagisce con l'acqua per produrre acido fosforo, un oxácido e acido cloridrico, un acido aloidrico.
PCL3 + 3h2O => h3Po3 + HCl
E fosforo pentacloruro, PCL5, reagisce con l'acqua per dare acido fosforico e acido cloridrico.
PCL5 + 4 H₂O => H3Po4 + HCl
Oxcacidi metallici
Alcuni metalli di transizione formano ossidi acidi, cioè si dissolvono nell'acqua per dare ossacidi.
Ossido di manganese (VII) (anidrum permanico) MN2O7 E l'ossido di cromo (VI) sono gli esempi più comuni.
Mn2O7 + H₂o => hmno4 (acido permanganico)
CRO3 + H₂o => h2CRO4 (acido cromico)
Nomenclatura
Calcolo di Valencia
Nominare correttamente un oxácid. A partire dalla formula generica heo, viene considerato quanto segue:
- L'o ha Valencia -2.
- Il Valencia de los H es +1.
Con questo in mente, l'Oxácid. Quindi, hai la seguente somma algebrica:
-2 + 1 + E = 0
E = 1
Pertanto, E è +1 Valencia.
Quindi le possibili valenze che possono avere e. Se tra le loro valenze ci sono valori +1, +3 e +4, e quindi "lavoro" con la sua valencia minore.
Nome acido
Nominare heo inizia chiamandolo acido, seguito dal nome di E con i suffissi -ico, se lavori con il più grande Valencia, o -ono, se lavori con il minore. Quando ci sono tre o più, gli ipo-prefissi vengono usati per fare riferimento al minore e alla maggiore delle valenze.
Quindi, Heo sarebbe chiamato:
Acido singhiozzo(Nome di E)orso
Poiché +1 è il minimo delle sue tre valenze. E se fosse heo2, Allora avrei Valencia +3 e sarebbe chiamato:
Può servirti: difenilamminaAcido (E)orso
E allo stesso modo per heo3, Con E che lavora con Valencia +5:
Acido (E)ICO
Esempi
- Acido cromico (h2Cr2O4). È un acido forte e instabile ad alte temperature.
- Acido dicromico (h2Cr2O7). La sua presenza è evidente nelle miscele di acido cromico utilizzato per pulire il vetro.
- Acido ipocloroso (HCLO). Riparare rapidamente i tessuti cutanei.
- Acido bromoso (HBRO2). È un composto intermedio e instabile. Composto bromo.
- Acido ortofosforico (H3Po4). Acido irritante per la pelle non alimentata.
- Acido permanganico (HMNO4). Acido molto forte.
- Acido periódic (Hio4). In chimica organica viene utilizzato per analizzare le strutture di altre molecole.
- Acido bromico (HBRO3). Oxcacid di bromo. I suoi sali sono fortemente ossidanti.
- Acido ipobromoso (HBRO). È usato in soluzione acquosa diluita ed è ottenuto dalla reazione tra acqua e BR2.
- Acido metafosforico (HPO3). Molto corrosivo, incolore e toilette solido a temperatura ambiente.
- Acido yodium (Hio3). Reattivo usato per rilevare la morfina in un prodotto.
- Acido zolfo (h2SW3). Causando pioggia acida.
- Acido solforico (h2SW4). Regolare per la lavorazione e i fertilizzanti dei metalli, è uno dei composti chimici più utilizzati.
- Acido nitrico (HNO3). Reagente di laboratorio, molto pericoloso perché può bruciare la pelle.
- Acido clorico (HCLO3). Durante la decomposizione produce molti prodotti. È stabile a freddo a una concentrazione del 30%.
- Arsenioso Acid (H3Aso3). Contiene arsenico ed è molto tossico e cancerogeno. È usato in erbicidi e pesticidi.
- Acido ortosilicico (h4Sio4). Acido debole usato come supporto o agente essiccante.
- Acido carbonico (h2Co3). È usato per fare bevande analcoliche.
- Acido nitroso (HNO2). In soluzione è notevolmente dissociata.
- Acido metaborico (HBO2). Solido bianco cristallino leggermente solubile.
Riferimenti
- Composti ossoacidi comuni. Recuperato da Thoughtco.com.

