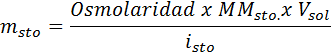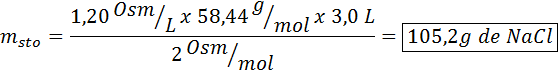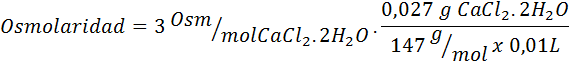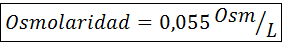Osmolarità
- 4346
- 1169
- Brigitta Ferrari
Cos'è l'osmolarità?
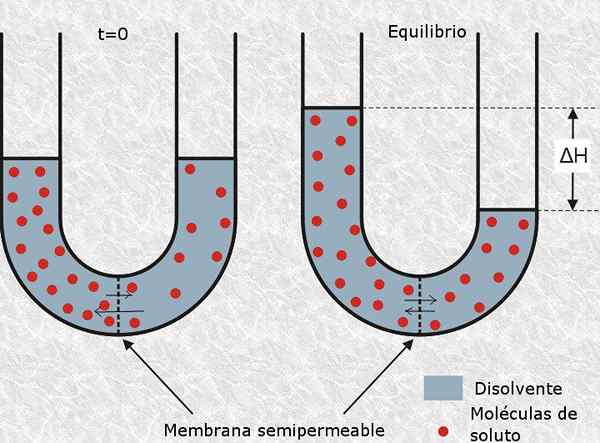
IL Osmolarità È un'unità di concentrazione che indica la concentrazione molare dell'insieme di particelle osmoticamente attive presenti in una soluzione. In altre parole, l'osmolarità è la molarità delle particelle osmoticamente.
è definito come particella osmoticamente attiva a quella molecola neutra o ionica che non può attraversare una membrana semipermeabile, come la membrana cellulare. La presenza di questo tipo di particelle genera pressione osmotica nella soluzione, e quindi il suo nome.
Viene chiamato il numero di moli di particelle osmoticamente attive Osmoles (rappresentato dal simbolo OSM), quindi l'osmolarità è espressa in unità di OSM/L.
L'importanza dell'osmolarità
L'osmolarità è un concetto di grande importanza per la biologia e la medicina, poiché l'equilibrio osmotico delle cellule con il loro ambiente è essenziale per la loro sopravvivenza. Ad esempio, iniettare una soluzione con un'osmolarità molto alta o molto bassa per via endovenosa, può facilmente causare la morte a un paziente.
 L'osmolarità è un aspetto essenziale delle soluzioni in medicina e biologia
L'osmolarità è un aspetto essenziale delle soluzioni in medicina e biologia D'altra parte, una tecnica molto comune che i biologi cellulari usano per rompere le cellule di diversi tipi è attraverso la lisi osmotica. Ciò consiste nel collocare le cellule in una soluzione ipotonica (con un'osmolarità molto bassa) in modo che l'acqua della soluzione le penetri dall'osmosi e le esplode.
Ciò lo rende molto importante, sia per i medici che per i biologi e i professionisti di altre aree, conoscendo, misurando o sapendo come calcolare l'osmolarità di una soluzione.
Può servirti: concentrazione percentualeDifferenze tra osmolarità e osmolalità
Quando si parla di osmolarità, è anche necessario parlare di osmolalità. L'osmolalità è simile all'osmolarità, allo stesso modo in cui la moralità è simile alla molarità.
Mentre l'osmolarità indica il Numero di osmoles per litro di soluzione (OSM/L), L'osmolalità indica lo stesso, ma Per ogni chilogrammo di solvente (OSM/kg).
L'osmolalità ha il vantaggio che, non a seconda del volume della soluzione, né dipende dalla densità o dalla temperatura. Per questo motivo, una soluzione avrà la stessa osmolalità a 25 ° C di 37 ° C. D'altra parte, la sua osmolarità a 37 ° C sarà leggermente inferiore alla sua osmolarità a 25 ° C, a causa dell'aumento del volume di espansione termica.
L'osmolalità è generalmente più facile da misurare sperimentalmente rispetto all'osmolarità. Tuttavia, l'osmolarità è più facile da calcolare ed è un'unità più facile da lavorare quando si preparano diluizioni.
Come viene calcolata l'osmolarità di una soluzione?
Esistono diversi modi per calcolare l'osmolarità di una soluzione, a seconda delle informazioni contate. Può essere calcolato da:
- Le quantità di soluto e soluzione.
- La molarità dei soluti presenti.
- Concentrazioni di ioni individuali.
- La percentuale M/V dei soluti, tra gli altri.
In tutti i casi, il calcolo si basa sulla formula generale dell'osmolarità, che è:

Dove NOSM È il numero di osmoles presenti nella soluzione e Vsole È il volume dello stesso espresso in litri. Il numero di osmoles viene calcolato moltiplicando il numero di moli nel soluto per il numero di particelle in cui si dissocia in soluzione.
Può servirti: miscele eterogenee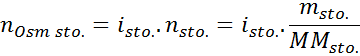
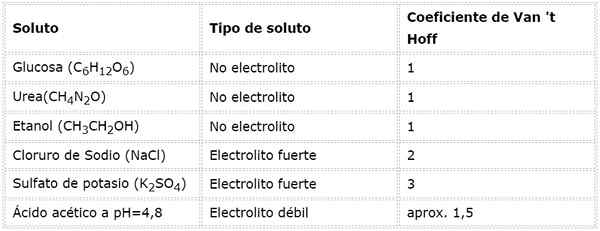
In questa equazione, NSto È il numero di moli di soluto, MSto è la sua massa (in g), MmSto È la sua massa molare (in g/mol) e YoSto È il coefficiente di van 't hoff del soluto. Questo coefficiente ha un valore di 1 per soluti non elettroliti (Come il glucosio, per esempio).
Per elettroliti forti che sono completamente dissociati (come cloruro di sodio, NaCl) il coefficiente di van 't hoff è uguale al numero totale di ioni in cui ogni mole del composto si dissocia.
Ad esempio, nel caso del solfato di potassio, K2SW4, la cui reazione di dissociazione è:
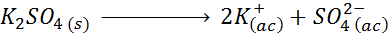
Ogni mole di sale che si dissolve produce 3 moli di ioni (2 K ioni+ E 1 così ione42-), quindi I = n = 3.
Nel caso di elettroliti deboli, il calcolo è più complicato, ma di solito sono determinati sperimentalmente. La tabella seguente riassume i coefficienti di van 't hoff per alcuni soluti comuni.
Esempi di calcolo dell'osmolarità
1. Esempio 1
Determinare l'osmolarità di una soluzione preparata dissolvendo 10 g di NaCl e 10 g di glucosio in 100 ml di soluzione
Soluzione: In questo caso, gli osmoles di ciascun soluto vengono calcolati separatamente e quindi aggiungono. Le masse molari sono rispettivamente di 58,45 g/mol e 180 g/mol e i coefficienti di VE 'T hoff sono 2 e 1:
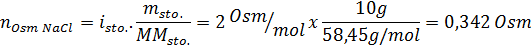
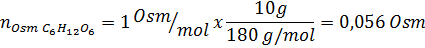
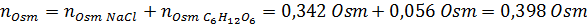
Ora calcoliamo l'osmolarità usando la formula, sapendo che 100 ml equivale a 0,100L:
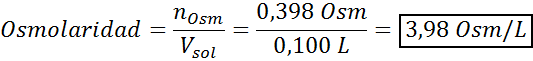
Infine, l'osmolarità della soluzione è 3,98 OSM/L.
2. Esempio 2
Determinare l'osmolarità di una soluzione 0,05 Soluzione di solfato di potassio Molare.
Soluzione: Se conosciamo già la molarità del soluto, il calcolo dell'osmolarità è semplice come moltiplicare questa concentrazione per il fattore di van.
Può servirti: benzaldeide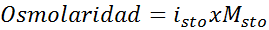
In questo caso, il fattore sale è 3.
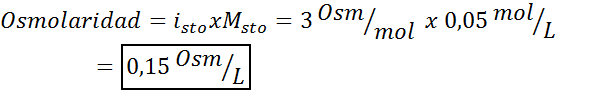
3. Esempio 3
Determinare l'osmolarità di un campione plasmatico contenente 0,125 M di sodio ioni, 0,020 M ioni di potassio e 0,145 ioni di cloruro.
Soluzione: L'osmolarità dei singoli ioni è uguale alla loro molarità, poiché gli ioni non si dissociano di più e hanno un I = 1. Per questo motivo, in questo caso è necessario solo moltiplicare I = 1 Ogni concentrazione e aggiunta:
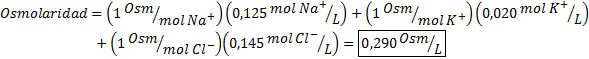
4. Esempio 4
Calcola l'osmolarità di una soluzione contenente 27 mg di CAP2.2h2O per ogni 10 ml di soluzione
Soluzione: Il peso molecolare Cochl2.2h2O sono 147 g/mol. Durante la dissoluzione, questo sale viene separato in 2 molecole d'acqua e tre ioni. Tuttavia, le molecole d'acqua non sono particelle osmoticamente attive, quindi non vengono prese in considerazione il calcolo dell'osmolarità e il coefficiente per questo composto è 3.

5. Esempio 5
Quale massa di cloruro di sodio è necessaria per preparare 3 litri di soluzione la cui osmolarità è 1,20 OSM/L?
Soluzione: In questo caso, poiché è richiesta la massa del soluto e abbiamo il volume e la concentrazione, è sufficiente liberare la massa della formula di osmolarità.