Nitrato di magnesio (Mg (NO3) 2) Struttura, proprietà, usi

- 967
- 204
- Baldassarre Ross
Lui Nitrato di magnesio È un solido inorganico la cui formula chimica è MG (no3)2. È un composto ionico formato dall'unione di un catione magnesio magico2+ e due anioni di nitrato no3-.
Il mg (no3)2 È un solido bianco cristallino. È molto igroscopico, cioè assorbe facilmente l'acqua dall'ambiente. Rimanendo in contatto con l'aria dell'ambiente, tende a formare il suo mg esaidrato (no3)2 •6h2O.
 Nitrato di magnesio mg (no3)2 polvere. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons.
Nitrato di magnesio mg (no3)2 polvere. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons. Mag Nitrato esaidrato (no3)2 •6h2O Ha nella sua struttura cristallina 6 molecole d'acqua h2O per ogni molecola mg (no3)2. Il nitrato di magnesio si trova nelle caverne e nelle miniere sotto forma di nitromagneso minerale.
Il mg (no3)2 Si ottiene commercialmente reagendo il metallo mg con acido nitrico HNO3.
Ha usi molto vari, come l'agricoltura come fertilizzante perché fornisce elementi nutrienti per piante come azoto (N) e magnesio (MG).
Viene utilizzato nel settore dei fuochi d'artificio o nella pirotecnica e anche nell'ottenimento dell'acido nitrico concentrato. È usato nell'analisi chimica, in esperimenti di fisica e studi medici e scientifici.
[TOC]
Struttura
Il nitrato di anidro magnesio è formato da un catione magnesio2+ e due anioni di nitrato no3-.
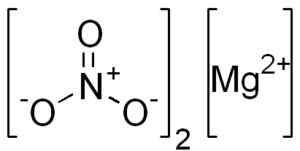 Struttura mg (no3)2. EDGAR181 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura mg (no3)2. EDGAR181 [dominio pubblico]. Fonte: Wikimedia Commons. Lo ione Magnesio Mg2+ Ha una configurazione elettronica: 1s2, 2s2 2 p6, 3s0, Bene, i due elettroni dello strato più esterno (3S) hanno prodotto. Questa conformazione è molto stabile.
Lo ione no3- Ha una struttura piatta e simmetrica.
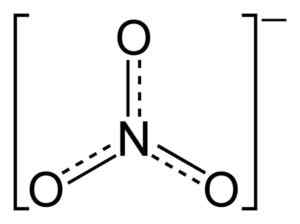 Struttura ionica di nitrato piatto NO3-. Le linee tratteggiate indicano l'equa distribuzione di elettroni tra i tre legami N-O. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura ionica di nitrato piatto NO3-. Le linee tratteggiate indicano l'equa distribuzione di elettroni tra i tre legami N-O. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Nella struttura del no3- Il carico negativo viene continuamente distribuito tra i tre atomi di ossigeno.
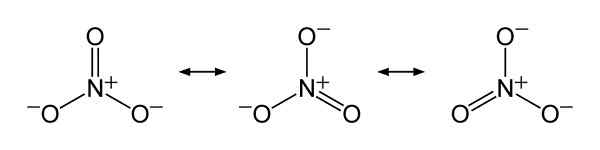 Strutture di risonanza ionica di nitrato NO3-, Spiegare l'equa distribuzione del carico negativo tra i tre atomi di ossigeno. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Strutture di risonanza ionica di nitrato NO3-, Spiegare l'equa distribuzione del carico negativo tra i tre atomi di ossigeno. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Nomenclatura
-Nitrato di anidro magnesio: mg (no3)2
Può servirti: acqua distillata-Nitrato di magnesio diidratato: mg (no3)2 •2h2O
-Nitrato di magnesio esaidrato: MG (no3)2 •6h2O
-Dinitrato di magnesio
Proprietà
Stato fisico
-Mg (n3)2 Anidro: solido bianco, cristalli cubici.
-Mg (n3)2 Diidrado: solido bianco cristallino.
-Mg (n3)2 Esatto: cristalli monoclinici solidi incolori
Peso molecolare
-Mg (n3)2 Anidro: 148,31 g/mol
-Mg (n3)2 Esaidrato: 256,41 g/mol
Punto di fusione
-Mg (n3)2 Esaidrato: 88,9 ºC
Punto di ebollizione
-Mg (n3)2 Esaidrato: non bollire, decomporre a 330 ° C
Densità
-Mg (n3)2 Anidro: 2,32 g/cm3
-Mg (n3)2 Diidratato: 1.456 g/cm3
-Mg (n3)2 Esaidrato: 1.464 g/cm3
Solubilità
Il nitrato di anidro magnesio è molto solubile in acqua: 62,1 g/100 ml a 0 ºC; 69,5 g/100 ml a 20 ºC. È anche molto igroscopico, essere in contatto con l'aria forma rapidamente esaidrato.
Il mg (no3)2 Dihydrado è anche molto solubile in acqua ed etanolo. È igroscopico.
Il mg (no3)2 L'esaidrato è anche molto solubile in acqua. È moderatamente solubile in etanolo. È la più stabile dei tre a contatto con l'aria, cioè dei tre è quello che assorbe meno l'acqua dall'ambiente.
Effetto di riscaldamento
Inviando una soluzione acquosa di MG (no3)2 All'evaporazione dell'acqua, il sale che cristallizza è esaidrato: mg (no3)2 •6h2O. Esaidrato significa che nel solido ogni molecola mg (no3)2 È collegato a 6 molecole d'acqua.
C'è anche mg diidrato (no3)2 •2h2O, in cui il MG (no3)2 Il solido è attaccato a 2 molecole d'acqua.
Riscaldando mg esaidrato (no3)2 •6h2Oppure il sale Anhydra non si ottiene, perché il nitrato di magnesio ha un'alta affinità per l'acqua.
Per questo motivo, riscaldandolo sopra il suo punto di fusione, un sale di nitrato misto e idrossido di magnesio Mg (NO3)2 •4mg (oh)2.
Questo sale misto, quando raggiunge i 400 ºC, si decompone in ossido di magnesio e stacca i gas di ossidi di azoto.
Può servirti: ipoclorito di calcio (CA (CLO) 2)Ottenimento
Può essere preparato reagendo con carbonato di magnesio MGCO3 Con acido nitrico HNO3, Rinunciamento a anidride carbonica co2:
Mgco3 + 2 hno3 → mg (no3)2 + Co2↑ + h2O
Può anche essere ottenuto con idrossido di magnesio mg (OH)2 e acido nitrico:
Mg (oh)2 + 2 hno3 → mg (no3)2 + 2 h2O
Ottenuto commercialmente in diversi modi:
1- reagente magnesio mg con acido nitrico HNO3.
2- per reazione dell'ossido di magnesio MGO con acido nitrico HNO3.
3- UNIMIO MG (OH) idrossido di magnesio2 e nitrato di ammonio NH4NO3, Formare nitrato di magnesio con distacco di ammoniaca NH3.
Posizione nella natura
Il mg (no3)2 L'esaidrato si trova naturalmente in miniere e grotte o caverne sotto forma di minerale di nitromagnesite.
Questo minerale è presente quando il guano entra in contatto con le rocce ricche in magnesio. Il guano è il materiale derivante dagli escrementi di uccelli marini e sigilli in ambienti molto secchi.
Applicazioni
Il mg (no3)2 L'esaidrato è usato nelle industrie in ceramica, chimica e agricoltura.
Questo composto è un fertilizzante perché fornisce azoto (N), che è uno dei tre elementi di base richiesti dalle piante e magnesio (mg) che è anche un componente secondario importante anche per questi.
In questo modo viene utilizzato con altri ingredienti nelle serre e nella cultura idroponica. Quest'ultimo è coltivare le piante in una soluzione acquosa con sali di fertilizzante anziché il suolo.
 Cultura idroponica. Puoi vedere i canali attraverso i quali circola la soluzione acquosa con sali di fertilizzanti come il nitrato di magnesio Mg (no3)2. Autore: Marsraw. Fonte: Pixabay.
Cultura idroponica. Puoi vedere i canali attraverso i quali circola la soluzione acquosa con sali di fertilizzanti come il nitrato di magnesio Mg (no3)2. Autore: Marsraw. Fonte: Pixabay. Viene anche usato come catalizzatore per ottenere composti petrolchimici. Consente di regolare la viscosità in alcuni processi. Il nitrato di anidro magnesio è usato in pirotecnica, cioè per la produzione di fuochi d'artificio.
 I fuochi d'artificio contengono nitrato di magnesio mg (no3)2. Autore: Free-Goos. Fonte: Pixabay.
I fuochi d'artificio contengono nitrato di magnesio mg (no3)2. Autore: Free-Goos. Fonte: Pixabay. Il nitrato di anidro magnesio è un agente disidratante. Viene utilizzato ad esempio per ottenere acido nitrico concentrato, poiché elimina l'acqua e concentra vapori acidi fino al 90-95% di HNO3.
Può servirti: regola diagonale Acido nitrico concentrato. Il caricatore originale era fabexpzionale alla Wikipedia italiana. [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons.
Acido nitrico concentrato. Il caricatore originale era fabexpzionale alla Wikipedia italiana. [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons. Viene anche usato per coprire il nitrato di ammonio e consentire la formazione di perle di tale materiale compresso.
Ha utilità nella formulazione dell'inchiostro, toner (polvere nera utilizzata nei sistemi fotocopiati) e prodotti da colorare. Funge da standard di magnesio nella chimica analitica.
Magnesio e cerio mg di sale nitrato (no3)2 •Cipiglio3)3 È interessante per gli esperimenti di fisica a basse temperature, in quanto viene utilizzato come refrigerante negli esperimenti di sumagnetizzazione adiabatica (senza trasferimento di calore).
Questo sale di magnesio e Cerio è stato utilizzato per stabilire livelli di temperature estremamente bassi della scala Kelvin (vicino allo zero assoluto).
In studi recenti
Diversi ricercatori hanno usato MG (no3)2 Nelle composizioni con polimeri sintetici e naturali per aumentare la conducibilità nelle batterie di magnesio.
È stato anche studiato nella costruzione di supercaugades per lo stoccaggio di energia ad alta potenza.
Negli studi sulla malattia
Il nitrato di magnesio è stato somministrato ai ratti da laboratorio con ipertensione arteriosa (alta pressione) e si è scoperto che la pressione sanguigna diminuisce e attenua o attenua o ammorbidisce gli effetti delle complicanze di questa malattia.
Ha anche dimostrato effetti protettivi contro i disturbi neurologici (disturbo nei neuroni) e contro la morte nei ratti durante i processi di cactoning dell'arteria carotidea.
Riferimenti
- Qian, m. et al. (2018). Carboni porosi porosi porosi di elevata capacità di Extrainy da Pechini Combustion of Magnesio Nitrate Gel. ACS Applter Mater Interfaces 2018, 10 (1): 381-388. NCBI recuperato.Nlm.NIH.Gov.
- Manjuladevi, r. et al. (2018). Uno studio sull'elettrolita polimerico di miscela basato su poli. Ionics (2018) 24: 3493. Link recuperato.Springer.com.
- Kiruthika, s. et al. (2019). Elettrolita biopolimero ecologico, pectina con sale di nitrato di magnesio, per l'applicazione in dispositivi electochimici. J Solid State Electochem (2019) 23: 2181. Link recuperato.Springer.com.
- Vilskerts r. et al. (2014). Il nitrato di magnesio attenua l'aumento della pressione sanguigna nei ratti SHR. Magnes Res 2014, 27 (1): 16-24. NCBI recuperato.Nlm.NIH.Gov.
- Kuzenkov v.S. e Krushinskii a.L. (2014). Effetto protettivo del nitrato di magnesio dai disturbi neurologici provocati dall'ischemia cerebrale nei ratti. Bull Exp Biol Med 2014, 157 (6): 721-3. NCBI recuperato.Nlm.NIH.Gov.
- Ropp, r.C. (2013). Gruppo 15 (N, P, AS, SB e BI) Composti della Terra alcalina. Nitrato di magnesio. Nell'enciclopedia dei composti terrestri alcalini. Recuperato da ScienceDirect.com.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 1. Quarta edizione. John Wiley & Sons.
- O.S. Biblioteca nazionale di medicina. (2019). Nitrato di magnesio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- « Concetto e caratteristiche del sistema tecnico, elementi, esempi
- Numero di massa di cosa consiste e come ottenerlo (con esempi) »

