Metodi di separazione di miscele omogenee
- 4688
- 636
- Baldassarre Ross
IL Metodi di separazione di miscele omogenee Sono tutti coloro che, senza usare reazioni chimiche, consentono di ottenere i componenti o i soluti che integrano la stessa fase; cioè di un liquido, solido o di gas.
Tali miscele omogenee sono costituite da soluzioni, in cui le particelle di soluto sono troppo piccole per essere in grado di distinguerle con gli occhi nudi. Sono così piccoli che non ci sono filtri stretti o selettivi per trattenerli mentre la soluzione li trasferisce. Né tecniche come la centrifugazione o la magnetizzazione aiutano la separazione.
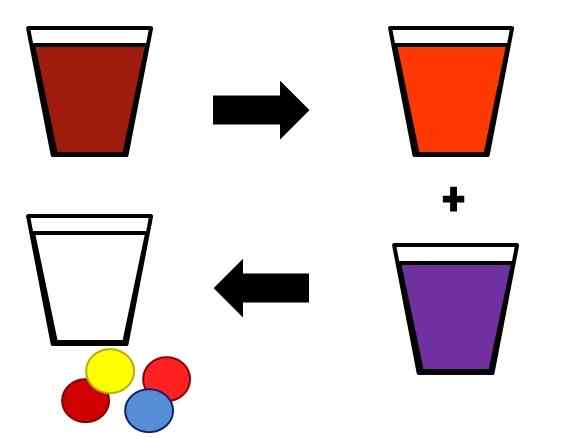 Esempio illustrativo di come le miscele omogenee possano separarsi nelle fasi. Fonte: Gabriel Bolívar.
Esempio illustrativo di come le miscele omogenee possano separarsi nelle fasi. Fonte: Gabriel Bolívar. Un esempio di come le soluzioni sono separate nei loro componenti è mostrato sopra. La miscela iniziale (marrone) è separata in due componenti, altrettanto omogenei (arancione e viola). Infine, dalle due miscele risultanti, si ottengono il solvente (bianco) e le rispettive coppie di soluti (giallo rosso e blu rosso).
Tra i metodi o le tecniche di separazione delle soluzioni abbiamo evaporazione, distillazione, cromatografia e cristallizzazione frazionaria. A seconda della complessità della miscela, si dovrebbe usare più di uno di questi metodi fino a quando non rompe l'omogeneità.
[TOC]
I principali metodi di separazione delle miscele
- Evaporazione
 L'evaporazione è il metodo più semplice per separare le miscele omogenee da un singolo soluto.
L'evaporazione è il metodo più semplice per separare le miscele omogenee da un singolo soluto. Le miscele omogenee più semplici sono le soluzioni in cui un singolo soluto è stato sciolto. Ad esempio, nell'immagine superiore esiste una soluzione colorata a causa dell'assorbimento e del riflesso della luce visibile con le particelle del suo soluto.
Se si è mosso bene durante la sua preparazione, non ci saranno regioni più chiare o scure di altre; Sono tutti uguali, uniformi. Tali particelle colorate non possono essere separate dal solvente da qualsiasi metodo meccanico, quindi avrai bisogno di energia in calore (triangolo rosso) per raggiungerlo.
Può servirti: disolfuro di carbonio (CS2): struttura, proprietà, usi, rischiPertanto, la soluzione colorata viene riscaldata all'aperto per accelerare e consentire l'evaporazione del solvente al di fuori del suo contenitore. In questo modo, il volume che separa le particelle di soluto diminuisce e, quindi, le sue interazioni aumentano e finiscono lentamente i sedimenti.
Il risultato finale è che il soluto colorato rimane nella parte inferiore del contenitore e il solvente è completamente evaporato.
L'inconveniente con l'evaporazione è che, piuttosto che separare i soluti, il suo obiettivo è quello di eliminare il solvente riscaldandolo al suo punto di ebollizione. Il solido rimanente può essere composto da più di un soluto ed è quindi richiesto da altri metodi di separazione per definirlo nei suoi componenti isolati.
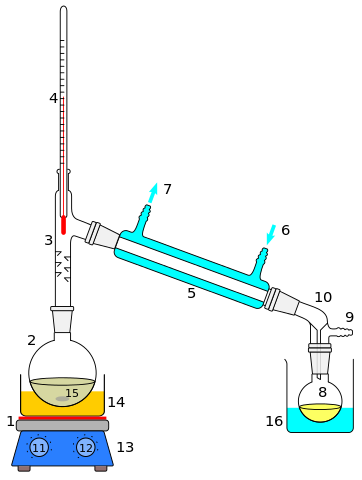
- Distillazione
 Distillazione
Distillazione La distillazione è forse il metodo di separazione di soluzioni omogenee o miscele. Il suo uso si estende a sali o metalli fusi, gas condensati, miscele di solventi o estratti organici. Il soluto è nella maggior parte del tempo un liquido, il cui punto di ebollizione differisce in diversi gradi rispetto al solvente.
Quando la differenza tra tali punti di ebollizione è alta (maggiore di 70 ºC), viene utilizzata una semplice distillazione; E in caso contrario, viene eseguita una distillazione frazionaria. Entrambe le distillazioni hanno più assiemi o design, nonché una metodologia diversa per miscele di diversa natura chimica (volatile, reattivo, polare, apolare, ecc.).
Nella distillazione sono conservati sia il solvente che i soluti, e questa è una delle sue principali differenze per quanto riguarda l'evaporazione.
Tuttavia, la rotaevaporazione combina questi due aspetti: una miscela solida liquida o liquida liquida, come quella di un olio disciolto e miscibile, si riscaldano fino a quando il solvente non viene rimosso, ma viene raccolta in un altro contenitore mentre il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il solido o il Il petrolio rimane nel contenitore iniziale.
Può servirti: tavola periodica, a cosa serveDistillazione d'aria
L'aria condensata è sottoposta a distillazione frazionaria criogenica per separare ossigeno, azoto, argon, neon, ecc. L'aria, una miscela gassosa omogenea, viene trasformata in un liquido in cui l'azoto, perché è la componente di maggioranza, agisce in teoria come solvente; E gli altri gas, anche condensati, come soluti liquidi.
- Cromatografia
La cromatografia, a differenza di altre tecniche, non può fornire rese o da remoto simile; Cioè, non è utile elaborare un'intera miscela, ma una frazione insignificante della stessa. Tuttavia, le informazioni che forniscono sono analiticamente preziose, in quanto identifica e classifica le miscele in base alla sua composizione.
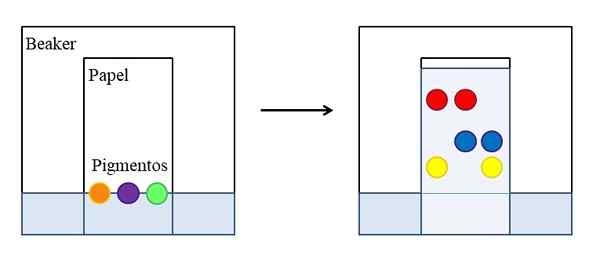 Cromatografia di carta o strato fine. Fonte: Gabriel Bolívar.
Cromatografia di carta o strato fine. Fonte: Gabriel Bolívar. Esistono diversi tipi di cromatografie, ma il più semplice, che è spiegato nelle scuole o corsi pre -university, è quello del documento, il cui principio è lo stesso di quello sviluppato su uno strato fine di un materiale assorbente (comunemente gel di silice ).
L'immagine superiore mostra che in un becher, pieno d'acqua o un solvente specifico, viene posizionata una carta che è stata contrassegnata con una linea di riferimento con gocce o punti di tre pigmenti selezionati (arancione, viola e verde). Il becher rimane chiuso in modo che la pressione sia costante e satura dai vapori del solvente.
Quindi, il liquido inizia a salire dalla carta e trascina i pigmenti. Le interazioni con la piega del pigmento non sono tutte uguali: alcune sono più forti e altri più deboli. Più affinità si sente il pigmento per la carta, meno aumenterà attraverso la carta rispetto alla linea che è stata inizialmente contrassegnata.
Può servirti: costante di velocitàAd esempio: il pigmento rosso è quello che prova meno affinità per il solvente, mentre il giallo a malapena è salito perché la carta lo conserva di più. Si dice quindi che il solvente sia la fase mobile e la carta stazionaria.
- Cristallizzazione frazionaria
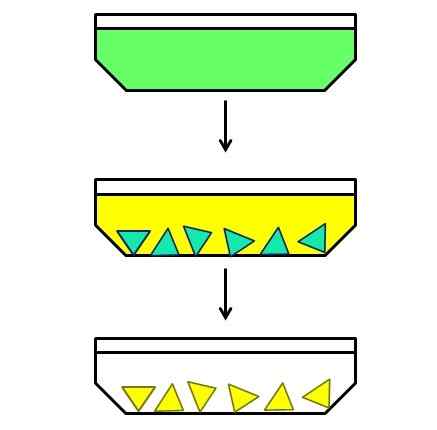 Esempio illustrativo di cristallizzazione frazionaria. Fonte: Gabriel Bolívar.
Esempio illustrativo di cristallizzazione frazionaria. Fonte: Gabriel Bolívar. E infine hai una cristallizzazione frazionaria. Questo metodo potrebbe forse catalogare come un ibrido, perché parte da una miscela omogenea per porre fine a un eterogeneo. Ad esempio, supponiamo che esista una soluzione in cui un solido verde è stato sciolto (immagine superiore).
Le particelle verdi sono troppo piccole per separarsi manualmente o meccanicamente. È anche che il solido verde è una miscela di due componenti e non un singolo composto di questo colore.
Quindi, una soluzione di esso viene riscaldata e lasciata a riposo durante il raffreddamento. Si scopre che i due componenti, sebbene molto correlati tra loro, il loro solvente solvente sono leggermente diversi; Pertanto, uno dei due inizierà prima a cristallizzazione e poi l'altro.
Il componente verde-blu (nel mezzo dell'immagine) è il primo a cristallizzare, mentre il componente giallo è ancora sciolto. Essendo cristalli blu verde, sono caldi prima che appaiano cristalli gialli. Quindi, mentre il solvente si raffredda un po 'di più, il giallo si cristallizza e un'altra filtrazione viene fatta.
Temi di interesse
Metodi di separazione della miscela.
Metodi di separazione di miscele eterogenee.
Miscele: componenti e tipi.
Miscele omogenee.
Miscele eterogenee.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Chelsea Schuyler. (2019). Cromatografia, distillion e filtrione: metodi per separare le miscele. Studio. Recuperato da: studio.com
- Fondazione CK-12. (16 ottobre 2019). Metodi per separare le miscele. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Buona scienza. (2019). Separazione di miscele. Recuperato da: Goodscience.com.Au
- Clark Jim. (2007). Cromatografia a strato sottile. Recuperato da: ChemGuide.co.UK
- « Struttura (PM) promessa (PM), proprietà, ottenimento, usi
- Caratteristiche, funzioni ed esempi della funzione metalinguistica »

