Modello corpuscolare della materia
- 1466
- 179
- Dott. Rodolfo Gatti
 Gli stati più noti della questione hanno la loro spiegazione nel modello corpuscolare della questione
Gli stati più noti della questione hanno la loro spiegazione nel modello corpuscolare della questione Qual è il modello corpuscolare della materia?
Lui Modello corpuscolare della materia È un modello della struttura microscopica della materia, che cerca di spiegare le proprietà e il comportamento in ogni stato di aggregazione.
Il postulato fondamentale del modello è che la materia è costituita da piccole particelle, che possono essere atomi, ioni o molecole, sempre in agitazione continua.
In questo modello si applicano le leggi della meccanica classica alle particelle, sebbene per grande numero presente non siano studiate individualmente ma attraverso un trattamento statistico. In questo modo si ottengono i valori medi delle magnitudini macroscopiche di interesse, come pressione, temperatura e volume.
Il modello corpuscolare spiega anche proprietà come viscosità, durezza, flessibilità e densità dei materiali, nonché dilatazione termica, tra gli altri fenomeni.
Origini del modello corpuscolare della materia
Le idee sulla natura corpuscolare della materia risalgono almeno al 5 ° secolo.C. Nell'antica Grecia, Leucipo (450 A. C. - 370 a. C.) e Democrito (da 460 a 370 a C), discepolo di ciò, avevano ipotizzato sull'organizzazione della materia a livello microscopico.
Questi filosofi hanno proposto che la materia è composta da minuscole particelle indivisibili, nominate atomi, Una parola di radice greca che significa esattamente "indivisibile".
La teoria è stata esclusa da Aristotele, il saggio più influente del suo tempo. Tuttavia, non è stato fino al diciassettesimo secolo che la teoria corpuscolare iniziò a prendere di nuovo rilevanza e, nel XIX secolo, i segreti della materia iniziarono finalmente a rivelare.
Nel 1803 il chimico inglese John Dalton (1766-1844) propose nuovamente che la questione fosse formata da corpuscoli chiamati atomi, che combinavano in alcune proporzioni per formare le molecole di una sostanza.
Gli atomi di Dalton erano indivisibili, ma presto fu sviluppata una solida struttura teorica, in particolare grazie a James C. Maxwell (1831-1979) e Ludwig Boltzmann (1844-1906). Ciò ha stabilito le basi della meccanica statistica e la fisica dello stato solido.
Può servirti: velocità media: formule, come viene calcolato e risoltoFondamenti del modello corpuscolare della materia
I principali postulati del modello sono:
- La materia, indipendentemente dal loro stato di aggregazione, è formata da particelle microscopiche, che possono essere atomi individuali o di combinazione, per formare molecole.
- Le diverse sostanze differiscono l'una dall'altra perché sono costituite da particelle diverse.
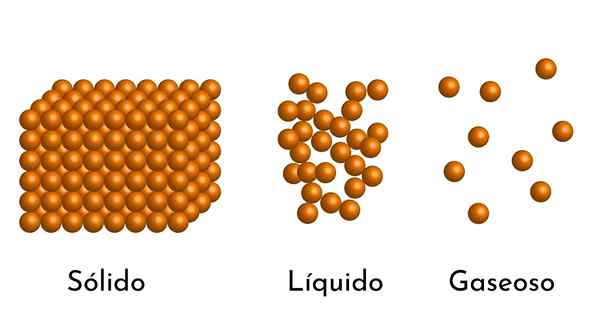
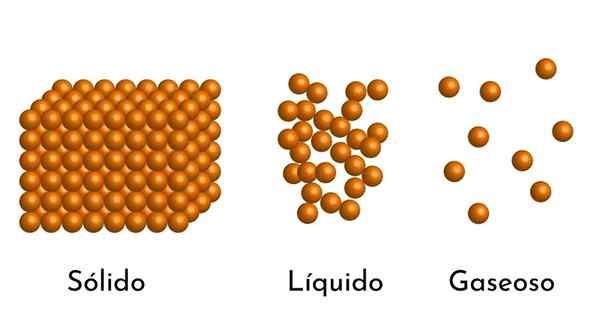
- Secondo lo stato di aggregazione della materia, ci sono spazi vuoti tra le particelle, più grandi nei gas e più piccoli nei solidi.
- Le particelle che costituiscono la questione sono in perpetua agitazione. A maggiore agitazione, maggiore energia cinetica ha e se viene aggiunto il calore, il movimento delle particelle viene aumentato.
- Inoltre, nei liquidi e nei solidi, l'attrazione delle particelle di diversa intensità, dovuta alle forze intermolecolari. Nei gas, le molecole sono molto separate e si muovono rapidamente, quindi queste forze non hanno una maggiore incidenza. Ma nei liquidi, le cui particelle hanno più coesione, queste forze sono più intense e nei solidi è ancora maggiore.
Teoria cinetica dei gas
Il modello corpuscolare è stato applicato prima ai gas, in quanto è lo stato di aggregazione più semplice e le forze di coesione tra le molecole sono minime. Inoltre, le proprietà dei gas erano ben note attraverso le opere sperimentali del chimico inglese Robert Boyle e del francese Joseph Gay Lussac e Jacques Charles.
Il modello di gas ideale, il più semplice, lo contempla:
- La dimensione delle particelle è molto più piccola delle distanze tra loro e che le dimensioni del contenitore. Sono masse specifiche, cioè mancanti di dimensioni e non occupano un volume.
- Le particelle sono in agitazione permanente, essendo il loro movimento solo di traduzione.
- Occasionalmente lo scontro di particelle elasticamente, tra loro e con le pareti del contenitore. In shock totalmente elastici, l'energia cinetica viene conservata.
- Non ci sono forze attraenti tra le molecole. Le uniche interazioni sono dovute a collisioni che si verificano di volta in volta e per un tempo molto breve. Del resto, ogni molecola agisce indipendentemente dagli altri.
- Se non ci sono forze esterne che agiscono sul sistema di particelle, queste sono distribuite uniformemente durante il volume disponibile.
Sebbene questo sia il modello più semplice, spiega il comportamento di qualsiasi gas denso ad alte temperature e basse pressioni. Gli scienziati hanno sviluppato altri modelli meglio adeguati al comportamento dei gas reali, per questo lo considerano:
- Le molecole hanno una dimensione misurabile.
- Le forze intermolecolari non vengono annullate.
Equazione del gas ideale
Grazie ai postulati del gas ideale, si presenta un'espressione che mette in relazione le magnitudini macroscopiche della pressione P, volume V e temperatura T:
P ∙ v = nrt
Dove n è il numero di moli di gas e r è la costante universale dei gas, il cui valore nelle unità del sistema internazionale è 8.314 J/mol ∙ K.
Energia e temperatura cinetica
In un gas ideale, tutta l'energia interna si manifesta come energia cinetica. L'energia cinetica media delle molecole N di un gas ideale è direttamente proporzionale alla sua temperatura in Kelvin:
Modello corpuscolare in liquidi e solidi
In realtà, tutta la questione può essere trovata nei tre stati più semplici: come gas, liquido o solido, a seconda della pressione e della temperatura. Ci sono altri stati di aggregazione come il plasma, ma non vicino alla superficie della terra.
Questi stati sono dovuti al modo in cui agiscono le forze di attrazione intermolecolare, che sono a corto, cioè non agiscono se la distanza tra le molecole è molto grande e le particelle si muovono ad alta velocità. Questo è il caso dei gas, che consente il fenomeno del diffusione Più veloce. Questo spiega che scoprendo l'aroma, l'aroma si diffonde rapidamente.
Può servirti: qual è il momento magnetico?D'altra parte, quando le particelle sono più vicine e il loro movimento è più lento, come nei liquidi e nei solidi, queste forze intermolecolari hanno l'opportunità di esercitare la loro azione.
Pertanto, quando un gas passa allo stato liquido, il suo volume diminuisce, perché la distanza tra le sue particelle diminuisce e ancora di più quando diventa solido.
Materia in stato liquido
Nello stato liquido, le forze intermolecolari non sono spregevoli, ma agiscono su una scala più piccola rispetto allo stato solido. Le particelle formano piccoli gruppi, che si disintegrano e si raggruppano continuamente, fornendo mobilità al materiale, sebbene mantengano un volume fisso.
Questa mobilità consente ai liquidi di adattarsi alla forma del contenitore e dà loro la capacità di fluire, oltre a essere in grado di mescolare più facilmente. La diffusione può verificarsi, ma più lentamente che nei gas.
Anche così, le particelle hanno abbastanza coesione in modo che il liquido rimanga incomprimibile in un ampio intervallo di temperatura.
Tensione superficiale
Sulla superficie del fluido ci sono molecole su cui agiscono le forze intermolecolari sbilanciate, dando origine a una forza netta su. Questa forza netta è ridotta al minimo quando il liquido ha la superficie più bassa possibile.
Grazie a questa forza, spille, clip, insetti e altri piccoli oggetti riescono a rimanere sulla superficie fissa dell'acqua senza affondarmi.
 In questa immagine una molecola può essere vista sulla superficie del liquido, su cui agisce una forza netta, che consente all'insetto di camminare sull'acqua senza affondare
In questa immagine una molecola può essere vista sulla superficie del liquido, su cui agisce una forza netta, che consente all'insetto di camminare sull'acqua senza affondare Matter a stato solido
In stato solido le particelle sono molto vicine l'una all'altra e le forze intermolecolari fanno sì che le particelle rimangono in posizioni fisse. Sebbene possano vibrare attorno a questa posizione, i solidi adottano una forma definita e mantengono il loro volume costante.
Quando il calore scorre, l'ampiezza del movimento vibratorio aumenta e la temperatura aumenta. Ciò provoca l'aumento delle dimensioni del corpo con la temperatura, un fenomeno chiamato Dilatazione termica. Se fluisce abbastanza calore, il solido può persino andare in fase liquida.


