Caratteristiche dei microfilamenti, struttura, funzioni, patologia
- 4957
- 932
- Zelida Gatti
IL microfilamenti o Filamenti di actina, sono uno dei tre componenti fondamentali del citoschelet cellulare eucariotico.
Negli eucarioti, i geni che codificano per i microfilamenti di actina sono altamente conservati in tutti gli organismi, quindi sono spesso usati come marcatori molecolari per vari studi.
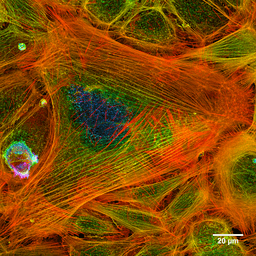
 Fotografia dei filamenti di actina di una cella tinta (Fonte: Howard Vindin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Fotografia dei filamenti di actina di una cella tinta (Fonte: Howard Vindin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) I microfilamenti sono distribuiti in tutto il citosol, ma sono particolarmente abbondanti nella regione sottostante alla membrana plasmatica, dove formano una rete complessa e sono associati ad altre proteine speciali per formare il citoscheletro.
Le reti di microfilamenti nel citoplasma delle cellule dei mammiferi sono codificate da due dei sei geni descritti per l'actina, che sono coinvolti nella dinamica dei microfilamenti e che sono persino molto importanti durante la differenziazione delle cellule staminali.
Molti autori concordano sul fatto che i microfilamenti sono le proteine più diverse, versatili e importanti del citoscheletro della maggior parte delle cellule eucariotiche, ed è importante ricordare che questi non si trovano nei microrganismi procariotici.
In questo tipo di cellule, tuttavia, ci sono filamenti omologhi ai microfilamenti, ma che sono formati da un'altra proteina: proteina MREB.
Al momento, si pensa che il gene che codifica per questa proteina sia un possibile gene ancestrale per l'actina eucariotica. Tuttavia, l'omologia della sequenza di aminoacidi che forma la proteina MREB è solo del 15% rispetto alla sequenza di actina.
Come una parte fondamentale del citoscheletro, qualsiasi difetto fenotipico sia nei microtubuli che nei filamenti intermedi e nei microfilamenti di actina (citoscheletro) può causare diverse cellule e patologie sistemiche.
[TOC]
Caratteristiche e struttura
I microfilamenti sono costituiti da monomeri proteici della famiglia Actina, che sono proteine contrattili estremamente abbondanti nelle cellule eucariotiche, poiché partecipano anche alla contrazione muscolare.
Questi filamenti hanno un diametro compreso tra 5 e 7 nm, quindi sono anche noti come filamenti sottili e sono composti da due forme di actina: la forma globulare (actina G) e la forma filamentosa (actina F).
Le proteine che partecipano al citoscheletro sono note come actine γ e β, mentre quelle che partecipano alla contrazione sono generalmente actine α.
Può servirti: citoplasma: funzioni, parti e caratteristicheLa percentuale di actina globulare e actina filamentosa nel citosol dipende dalle esigenze cellulari, poiché i microfilamenti sono strutture molto variabili e versatili, che sono costantemente crescita e accorciamento a causa della polimerizzazione e della depolimizzazione.
L'actina G è una piccola proteina globulare, costituita da quasi 400 aminoacidi e circa 43 kDa di peso molecolare.
I monomeri di actina che compongono i microfilamenti sono ordinati sotto forma di un filo elicoidale, poiché ognuno soffre di una torsione quando associato a quanto segue.
L'actina G è associata a una molecola Ca2+ e un altro ATP, che stabilizza la sua forma globulare; Mentre l'actina F è ottenuta dopo l'idrolisi del fosfato terminale della molecola ATP nell'actina G, il che contribuisce alla polimerizzazione.
Organizzazione
I filamenti di actina possono essere organizzati sotto forma di "raggi" o "reti" che hanno funzioni diverse all'interno delle cellule. Le travi formano strutture parallele collegate da ponti incrociati piuttosto rigidi.
Le reti, d'altra parte, sono strutture più comode, come le maglie a tre dimensioni con le proprietà dei gel semi -solidi.
Esistono molte proteine associate a filamenti di actina o microfilamento e che sono conosciute come ABP (dall'inglese Proteine leganti l'actina), che hanno siti specifici per questo.
Molte di queste proteine consentono ai microfilamenti di interagire con gli altri due componenti del citoscheletro: microtubuli e filamenti intermedi, nonché con gli altri componenti della faccia interna della membrana plasmatica.
Tra le altre proteine che interagiscono con i microfilamenti ci sono fogli nucleari e spettrina (nei globuli rossi).
Come si formano i filamenti di actina?
Poiché i monomeri di actina globulare si uniscono sempre allo stesso modo, orientati nella stessa direzione, i microfilamenti hanno una polarità definita, con due estremi: uno "in più" e uno "meno".
La polarità di questi filamenti è molto importante, poiché crescono considerevolmente più velocemente a causa della loro fine positiva, in cui vengono aggiunti i nuovi monomeri di actina.
 Rappresentazione grafica di microfilamenti di actina (fonte: lavoro derivato: retama (talk) thin_filament_formation.SVG: Mikael Häggström [dominio pubblico] via Wikimedia Commons)
Rappresentazione grafica di microfilamenti di actina (fonte: lavoro derivato: retama (talk) thin_filament_formation.SVG: Mikael Häggström [dominio pubblico] via Wikimedia Commons) La prima cosa che si svolge durante la polimerizzazione dei filamenti di actina è un processo noto come "nucleazione", che consiste nell'associazione di tre monomeri proteici.
Può servirti: plasomolisiA questo trimmer nuovi monomeri vengono aggiunti da entrambe le estremità, in modo che il filamento cresca. I monomeri di actin G sono in grado di idrolizzare ATP con ogni unione, che ha implicazioni nella velocità della polimerizzazione, poiché le porzioni di actina-ATP dissocano più difficoltà di Actin-ADP.
L'ATP non è necessario per la polimerizzazione e la funzione concreta della sua idrolisi non è stata ancora chiarita.
Alcuni autori considerano che, poiché gli eventi di polimerizzazione dell'actina sono rapidi.
Regolamento
Sia la polimerizzazione dei filamenti di actina che la sua depolimerizzazione sono processi altamente regolati da una serie di proteine specifiche, che sono responsabili del rimodellamento dei filamenti.
Esempio di proteine che regolano i depolimeri. Un'altra proteina, Profilaine, ha una funzione opposta, poiché stimola l'associazione dei monomeri (stimolando lo scambio di ADP con ATP).
Funzioni
I microfilamenti interagiscono con filamenti di miosina associati a proteine transmembrane che hanno un dominio in citosol e un'altra cellula all'estero, quindi partecipano ai processi di mobilità cellulare.
Questi microfilamenti associati alla membrana plasmatica mediano le diverse risposte cellulari a diversi tipi di stimoli. Ad esempio, l'adesione cellulare dei tessuti epiteliali è diretta dalle proteine transmembrane note come cadherinas, che interagiscono con i microfilamenti per reclutare fattori.
I filamenti di actina interagiscono con i filamenti intermedi per far trasmettere stimoli extracellulari a luoghi chiave come ribosomi e cromosomi all'interno del nucleo.
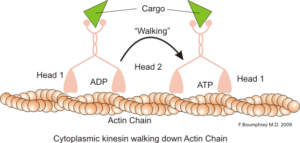 Rappresentazione della funzione motoria intracellulare dei microfilamenti di actina (fonte: boumphreyfr [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Rappresentazione della funzione motoria intracellulare dei microfilamenti di actina (fonte: boumphreyfr [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Una funzione classica e molto studiata dei microfilamenti è la sua capacità di formare "ponti", "binari" o "autostrade" per il movimento della proteina motoria miosina I, che è in grado di caricare le vescicole di trasporto dagli organelli al plasma di membrana sulla secretoria percorsi.
I microfilamenti interagiscono anche con la miosina II per stabilire l'anello contrattile che si forma durante la citochinesi, proprio durante l'ultima fase della divisione cellulare in cui il citosol è separato dalle cellule dello stelo e della figlia.
Può servirti: leucociti polimorfonucleariIn generale, i microfilamenti a forma di actina modulano la distribuzione di alcuni organelli come il complesso del Golgi, il reticolo endoplasmatico e i mitocondri. Inoltre, partecipano anche al posizionamento spaziale degli RNM in modo che vengano letti dai ribosomi.
L'intero set di microfilamenti del telefono cellulare, in particolare quelli che sono strettamente correlati alla membrana plasmatica, partecipano alla formazione di membrane cellulari ondulate di cellule che hanno un movimento attivo costante.
Partecipano anche alla formazione di microvani e altre protuberanze comuni sulla superficie di molte cellule.
Esempio di funzioni nel fegato
I microfilamenti partecipano al processo di secrezione biliare negli epatociti (cellule epatiche) e anche ai movimenti peristaltici (contrazione coordinata) dei canaliculi epatici.
Contribuiscono alla differenziazione dei domini della membrana plasmatica grazie alla loro associazione con diversi elementi citosolici e al controllo che esercitano sulla topografia di questi elementi intracellulari.
Patologie correlate
Esistono poche malattie associate a difetti primari nella struttura o con proteine e enzimi regolatori nella sintesi di microfilamenti, sebbene queste siano direttamente coinvolte in un gran numero di funzioni.
Il basso indice di malattie e malformazioni nella struttura primaria dei microfilamenti è dovuto al fatto che esistono generalmente geni codificanti multipli sia dell'actina che delle sue proteine regolatori, un fenomeno noto come "ridondanza genetica".
Una delle patologie più studiate è la vetrificazione degli ovociti sul loro citoscheletro, in cui si osserva un'interruzione nella rete di microfilamenti corticali, nonché una depolimerizzazione e una disorganizzazione dei microtubuli del fuso mitotico.
In termini generali, questa vetrificazione provoca dispersione cromosomica, poiché porta a un disaccordo nella compattazione dell'intera cromatina.
Le cellule che hanno una maggiore organizzazione e una proporzione di microfilamenti nel loro citoscheletro sono cellule muscolari striate, pertanto la maggior parte delle patologie sono associate a un malfunzionamento dell'apparato contrattile.
I microfilamenti difettosi o atipici sono stati anche associati alla malattia ossea nota come malattia da pagetto.
Riferimenti
- Aguilar-Cuenca, R., Llorente-González, c., Vicente, c., & Vicente-Manzares, M. (2017). La dinamica dell'adesione coordinata dal microfilamento guida la migrazione e le forme singole. F1000Resarch, 6.
- Due rimedi, c. G., Chhabra, d., Kekic, m., Dito, io. V., Tsubakihara, m., Berry, d. A., & Nosworthy, n. J. (2003). Actina delle proteine leganti: regolazione dei microfilamenti citoscheletrici. Recensioni fisiologiche, 83(2), 433-473.
- Guo, h., Fauci, l., Shelley, m., & Kanso, e. (2018). Bistabilità nella sincronizzazione dei microfilamenti attivati. Journal of Fluid Mechanics, 836, 304-323.
- Lancio., Langer, r., & Vacanti, J. P. (Eds.). (2011). Principi di ingegneria dei tessuti. Academic Press.
- Robbins, j. (2017). Malattie del citoscheletro: le deminopatie. Nelle miopatie cardioscheletriche nei bambini e negli adulti (PP. 173-192). Academic Press.
- « Caratteristiche dell'orso grizzly, habitat, cibo, comportamento
- Caratteristiche di Cistus clusii, tassonomia, habitat, distribuzione, usi »

