Caratteristiche della lince rossa, habitat, riproduzione, nutrizione

- 4962
- 769
- Baldassarre Ross
Lui Lynx rosso o gatto di montagna messicano (Lynx Rufus) è un mammifero americano della famiglia Felidae. È una delle quattro specie di Lince riconosciute in tutto il mondo e una delle meno minacciate.
Costituisce una delle due specie di Linces conosciute in Nord America, insieme alla lince canadese Lynx canadensis. È uno dei felini più e migliori studiati negli Stati Uniti, tuttavia molti aspetti della loro biologia rimangono sconosciuti a sud della sua distribuzione (Messico).
 Red Lynx (Lynx Rufus) di Marlin Harms [CC di 2.0 (https: // creativeCommons.Org/licenze/by/2.0)]
Red Lynx (Lynx Rufus) di Marlin Harms [CC di 2.0 (https: // creativeCommons.Org/licenze/by/2.0)] La lince rossa ha 12 sottospecie riconosciute in tutta la sua area di distribuzione tra cui lo sono L. R. Rufus, Baileyi, Californicus, Escuinapae, Fasciatus, Floridanus, Gigas, Oaxacensis, Pallescens, Peninsularis, Superorensis e Texensis.
Lince come gran parte dei gatti, sono animali solitari e con un modello di giorno e attività notturna. Molti autori indicano che la Lynx è un predatore opportunistico, tuttavia, altri sostengono che questo felino si è evoluto come un predatorio specializzato nella cattura dei lagomorfi.
Nonostante siano principalmente terrestri, si arrampicano molto bene a causa della presenza di artigli retrattili ben sviluppati. Young Young and Copies può nascondersi sugli alberi mentre la madre sta cacciando.
Red Lynx stabilisce territori che possono variare stagionalmente. I maschi di solito hanno un territorio più ampio, che si sovrappone a diverse femmine. Questo territorio tende ad espandersi nell'era riproduttiva e si riduce nelle femmine che hanno una piccola prole.
Inoltre, i cambiamenti nelle dimensioni del territorio sono un riflesso del modello di abbondanza di dighe. I maschi possono cacciare animali più grandi delle femmine a causa della differenza di dimensioni tra i sessi. Tuttavia, la selezione di dighe più piccole da parte delle femmine, sottolinea che si nutrono delle dighe di habitat più abbondanti.
[TOC]
Caratteristiche generali
La lince rossa è la specie più piccola delle quattro specie di lince nota. Lynx Rufus È una specie sessualmente dimorfica, essendo i maschi più grandi delle femmine.
Questi gatti possono raggiungere dimensioni fino a 63 cm di altezza per 1,6 metri di lunghezza, dalla testa alla punta della coda. Possono pesare in media tra 7 e 12 kg, sebbene le registrazioni di alcuni esemplari maschi superano i 18 kg.
La sua pelliccia è marrone rossastro, leggermente screpolata con toni grigi e neri nella regione dorsale. Nella regione laterale è più chiaro e la chiazza diminuisce verso la regione ventrale che ha una tonalità chiara con macchie nere sparse. Questa colorazione consente un buon camuffamento con il suo habitat naturale.
Le estremità hanno una colorazione simile alla regione dorsale. Le gambe anteriori hanno internamente un paio di bande nere che le distinguono dalle altre specie del genere. Le gambe sono lunghe, le orecchie sono puntate e la coda misura circa 20 centimetri ed è un bullone e con la punta nera.
https: // www.Youtube.com/orologio?V = nd2kjfdwvfw
Habitat e distribuzione
Habitat
La lince rossa occupa habitat abbastanza contrastanti. Negli Stati Uniti occupano foreste di conifere e miscele foreste boreali, foreste di legno a bassa terra, paludi costiere nel sud -est e deserti e boschetti a sud -ovest. In Messico possono occupare cespugli secchi e prati, nonché ambienti tropicali.
Può servirti: animali con oAltitudinalmente, possono occupare spazi dal livello del mare a 3500 metri di elevazione. Gli habitat che occupano possono variare dalle aree del deserto come il Deserto Sonora in Messico, dove sono molto comuni, cespugli di cespugli (scrub), savane, foreste e aree con prati.
Quei luoghi con un elevato intervento sotto forma di colture sono poco usati da questi gatti a causa della bassa disponibilità di dighe. Per questo motivo, sono più comuni nelle aree con una vegetazione densa, specialmente nei sotoboschi, dove stabiliscono le aree di stalking e la loro fuga e giovani laiories.
Distribuzione
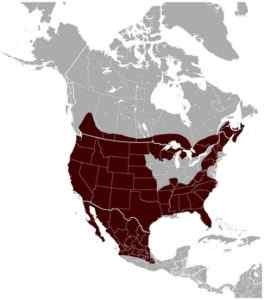 Red Lynx Distribution Lynx Rufus da parte dell'autore del work e i dati spaziali della lista rossa IUCN [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Red Lynx Distribution Lynx Rufus da parte dell'autore del work e i dati spaziali della lista rossa IUCN [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Le lince rosse hanno un'ampia distribuzione in Nord America, che occupa dal Canada meridionale, gran parte degli Stati Uniti allo stato di Oaxaca in Messico che costituisce il limite più meridionale della sua distribuzione. È l'unica specie di lince che occupa quasi tutta la sua distribuzione storica oggi.
La sua assenza a sud dell'istmo di Tehuantepec è probabilmente dovuta all'assenza di dighe e non alla concorrenza con specie ecologicamente simili. Questa specie sembra espandere la sua distribuzione a nord, in Canada, prodotto della deforestazione di foreste naturali.
Con l'applicazione di telecamere trap, è stata determinata la presenza di lince rossa a nord delle montagne rocciose canadesi, il che ha aumentato di più la sua estensione contrariamente a ciò che si pensava.
Negli Stati Uniti, durante il ventesimo secolo, furono praticamente cacciati fino alla sua eliminazione negli stati dell'Iowa, dell'Illinois, dell'Indiana, dell'Ohio e del Missouri a causa della perdita e dello sfruttamento dell'habitat. Tuttavia, attualmente le popolazioni in questi Stati si stanno riprendendo.
Parte della sua distribuzione nord si sovrappone con un altro tipo di lince più grande, Lynx canadensis.
Conservazione
Le tendenze della popolazione di questa specie sono stabili, tuttavia alcune pressioni regionalizzate possono essere una sfida per la conservazione.
Questa specie è inclusa nell'Appendice II delle CITE a causa del suo commercio. Negli ultimi 2 decenni, è stato il felino più commercializzato per le sue pelli.
Cacciare le pelli illegali, la perdita di habitat attribuita alla crescita delle aree urbanizzate e le attività di deforestazione sono le principali minacce in futuro.
D'altra parte, sono anche vulnerabili al consumo di roditori avvelenati nelle città e all'isolamento genetico causato dalla rottura della continuità degli habitat.
Lince frequenti habitat disturbato molto poco, quindi è molto raro osservarli dagli ecosistemi naturali. In alcune aree come la Florida hanno fortemente ridotto le loro popolazioni a causa dell'effetto causato dall'introduzione di specie esotiche come i pitoni della Birmania.
I conflitti con animali domestici come cani e gatti costituiscono anche una fonte di minaccia. Sono anche inclini alla trasmissione di malattie in alcune popolazioni a est del Canada e per correre quando usano le strade come aree di passaggio.
Riproduzione
I maschi di questa specie si riproducono con diverse femmine e nella stagione riproduttiva di solito espandono la loro gamma di movimento territoriale. In questo modo aumentano le possibilità di riprodurre con le femmine che hanno territori che si sovrappongono con i loro.
Può servirti: scarabeo HerculesI maschi mostrano una riduzione stagionale dell'attività spermatogena durante l'estate e l'inizio dell'autunno, ma questo modello è ridotto nei maschi maturi.
La stagione dell'accoppiamento varia quando cambiano altitudine, lunghezza, latitudine e variazioni climatiche. Eventi riproduttivi possono verificarsi durante tutto l'anno, tuttavia c'è un picco da agosto a dicembre.
La femmina nella fase di Proestro inizia a segnare con i suoi luoghi strategici di urina da rilevare dai maschi. La maggior parte delle nascite si verificano tra aprile e maggio. Alcune femmine che si riproducono in anticipo potrebbero avere una seconda lettiera alla fine dell'anno.
Le cucciolate possono variare tra 2 e 6 cuccioli che generalmente rimangono protetti nelle loro lairie fino a tre mesi di età. L'allattamento al seno può durare tra due e tre mesi. Le femmine si prendono cura dei loro giovani da sole fino a quando non acquisiscono le capacità per cacciare in modo indipendente e delimitare il proprio territorio.
 Lynx rosso in posizione di stalking Byarean [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
Lynx rosso in posizione di stalking Byarean [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] Nutrizione
Le lince rosse hanno una fiera Lynx Canadess.
La selezione delle dighe consumate da questo felino dipende in gran parte dalla disponibilità temporale che hanno nei territori che occupano.
I lagomorfi comprendono in molte delle località che occupano, oltre il 70% della dieta. La presenza di conigli è essenziale per stabilire una popolazione praticabile di lince rossa. Tra le specie lagomorfe più consumate ci sono Lepus sp, Romerolagus diazi, Sylvilagus audubonii, S. Cunicularius, S. Floridanus.
Inoltre, la lince può includere più di 20 specie aggiuntive nella loro dieta. Questi includono un'ampia varietà di piccoli roditori terrestri e una grande diversità di specie scoiattoli.
I maschi possono catturare grandi dighe, compresi i segni giovanili come i cervi del genere Odocoileus e altri mammiferi medi tra cui Tsigüeadas, sud -est, procioni e porcospini.
Possono anche catturare occasionalmente, quando le risorse sono limitate, diverse specie di uccelli e rettili come lucertole e serpenti. D'altra parte, gli animali domestici possono cacciare come cani, gatti e animali riproduttori.
Comportamento
Questi animali in generale hanno un comportamento sfuggente. Per questo motivo, gran parte delle informazioni ecologiche raccolte per questo animale sono state eseguite da strumenti come la telemetria e lo studio di animali morti a causa della caccia allo sport.
Territorialità
I linci maschi stabiliscono territori fino a 1,65 volte più grandi di quelli delle femmine. I territori delle femmine includono quasi 1 a 43 km2 mentre i maschi occupano da 3 a quasi 168 km2 Con una media di 39,7 km2. Per proteggere il loro territorio, segnano gli alberi con gli artigli o con sgabelli di feci e urine.
Femmine e maschi si espandono e contraggono il loro territorio a seconda della stagionalità, essendo i territori più ampi in entrambi i sessi durante la stagione invernale. I maschi occupano territori considerevolmente più grandi durante l'inverno.
Le densità di questi gatti variano in base all'area che occupano. Tendono ad essere favoriti in aree di mezza montagna, con alta copertura di boschetti e aree ripide con abbondanza di conifere.
Può servirti: 8 animali in pericolo di estinzione in puebla e causeD'altra parte, durante l'inverno, questo felino tende a occupare aree in cui gli strati di neve non sono così spessi. Durante questa stazione, di solito sono visti più frequentemente in aree chiare come strade, scogliere e piantagioni forestali di FIR.
 Lynx Rufus di Bighous2015 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Lynx Rufus di Bighous2015 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Comunicazione ed effetti delle urine
L'urina di questi felini ha un alto contenuto di composti di zolfo altamente efficace nella modifica del comportamento alimentare della loro preda.
Questi composti semiochimici si respingono ad animali come Odocoileus emionus, Odocoileus virginianus, Lepus Americanus E Marmota Monax impedire loro di causare danni alle piantagioni agroforestali.
Anche lo spruzzato di urina su alberi e rocce indica lo stato di salute, la condizione riproduttiva e la sua presenza prima di altri campioni. Questi tipi di segnali olfattivi costituiscono il principale meccanismo di comunicazione.
Inoltre, sono stati osservati sfregando la loro pelliccia contro la corteccia degli alberi e emettendo vocalizzazioni. Questi ultimi aspetti del loro comportamento rimangono poco studiati.
Riferimenti
- Allen, m. L., Wallace, c. F., & Wilmers, C. C. (2015). Modelli in Bobcat (Lynx Rufus) Comportamenti di marcatura e comunicazione. Journal of Ethology, 33(1), 9-14.
- Aranda, m., Rosas, o., Fiumi, j. D. J., & Garcia, N. (2002). Analisi comparativa dell'alimentazione del gatto di montagna (Lynx Rufus) In due diversi ambienti dal Messico. Atto zoologico messicano, (87), 99-109.
- Chamberlain, m. J., Leopoldo, b. D., & Conner, L. M. (2003). Uso dello spazio, movimenti e selezione dell'habitat di Bobcats adulti (Lynx Rufus) nel Mississippi centrale. Il naturalista delle Midland americane, 149(2), 395-406.
- Fritts, s. H., & Sealander, J. A. (1978). Diete di Bobcats in Arkansas con particolare riferimento all'età e alle differenze sessuali. The Journal of Wildlife Management, 533-539.
- Fritts, s. H., & Sealander, J. A. (1978). Biologia riproduttiva e caratteristiche della popolazione di Bobcats (Lynx Rufus) in Arkansas. Journal of Mammalogy, 59(2), 347-353.
- Gañán, n., González, r., Sestelo, a., Garde, J. J., Sánchez, i., Aguilar, J. M.,... e Roldan, e. R. S. (2009). Tratti riproduttivi maschili, criopresservazione del seme e fecondazione eterologa in vitro nel Bobcat (Lynx Rufus). Theiogenology, 72(3), 341-352.
- Kelly, m., Morin, d. & Lopez-Gonzalez, C.A. 2016. Lynx Rufus . L'elenco rosso IUCN di specie minacciate 2016: e.T12521A50655874. http: // dx.doi.org/10.2305/iucn.UK.2016-1.RLT.T12521A50655874.In. Scaricato il 25 dicembre 2019.
- Lovallo, m. J., & Anderson, e. M. (millenovecentonovantasei). Bobcat (Lynx Rufus) Dimensioni della gamma di case e uso dell'habitat nel nord -ovest del Wisconsin. Naturalista Midland americano, 241-252.
- Mattina, m. J. Yo., Pignatello, J. J., & Swihart, R. K. (1991). Identificazione di componenti volatili di Bobcat (Lynx Rufus) Urina. Journal of Chemical Ecology, 17(2), 451-462.
- McLean, m. L., McCay, t. S., & Lovallo, M. J. (2005). Influenza di età, sesso e periodo dell'anno sulla dieta del Bobcat (Lynx Rufus) in Pennsylvania. Il naturalista delle Midland americane, 153(2), 450-454.
- McCord, c. M. (1974). Selezione dell'habitat invernale di Bobcats (Lynx Rufus) Sulla riserva di quabbin, Massachusetts. Journal of Mammalogy, 55(2), 428-437.
- Parker, g. R., & Smith, G. E. J. (1983). Parametri riproduttivi e fisici specifici per sesso e sesso di Bobcat (Lynx Rufus) Sull'isola di Cape Breton, in Nuova Scozia. Canadian Journal of Zoology, 61(8), 1771-1782.
- Valencia-Herverth, r., & Valencia-Herverth, J. (2012). Presenza del gatto Montés (Lynx Rufus) Nelle giungle tropicali dello stato di Hidalgo, in Messico. THERYA, 3(1), 81-85.
- Winegarner, c. E., & Winegarner, m. S. (1982). Storia riproduttiva di un Bobcat. Journal of Mammalogy, 63(4), 680-682.
- « Caratteristiche Birds carpentiere, habitat, riproduzione, nutrizione
- Caratteristiche della scimmia Howlerator, habitat, riproduzione, comportamento »

