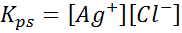Legge sull'azione di massa

- 3690
- 228
- Lidia Valentini
 Una reazione di precipitazione comporta l'equilibrio della solubilità, che è governata dalla legge sull'azione di massa
Una reazione di precipitazione comporta l'equilibrio della solubilità, che è governata dalla legge sull'azione di massa Qual è la legge sull'azione di massa?
IL Legge sull'azione di massa afferma che la velocità di una reazione dipende dalla concentrazione dei suoi reagenti sollevati ai suoi coefficienti stechiometrici. Questa legge consente di relazionarsi tra loro le concentrazioni nell'equilibrio dei reagenti e dei prodotti di una reazione chimica reversibile. In altre parole, stabilisce la formula della costante di equilibrio.
La legge sull'azione di massa è stata enunciata dai chimici norvegesi (e crema) Cato m. Guldberg (1836-1902) e Peter Waage (1833-1900) nel 1864. Questa è una delle leggi fondamentali della chimica, poiché ci consente di calcolare le concentrazioni finali in equilibrio dagli importi iniziali.
Inoltre, la legge di massa ci consente anche di comprendere facilmente gli effetti dei cambiamenti nelle concentrazioni di una delle specie su equilibrio. In altre parole, ci consente di capire come funzionano i principi di Le Chatlier.
Nonostante essere chiamato "legge di azione di massa", non si riferisce davvero alle masse dei reagenti e dei prodotti, ma, piuttosto, alle loro concentrazioni. Il motivo per cui si chiama Mass Action Law e non la legge dell'azione delle concentrazioni è perché la concentrazione era chiamata "massa attiva".
La legge sull'azione di massa e la costante di equilibrio
Secondo la legge sull'azione di massa, quando le reazioni reversibili raggiungono l'equilibrio non è perché la reazione si ferma. Al contrario, l'equilibrio viene raggiunto quando la velocità della reazione diretta viene eseguita pari alla velocità della reazione inversa. Quando ciò accade, tutte le specie chimiche si verificano e consumate alla stessa velocità, quindi le loro concentrazioni diventano costanti (smettono di cambiare).
Può servirti: toluene: struttura, proprietà, usi, ottenimentoGuldberg e Waage hanno scoperto che le velocità di entrambe le reazioni (la diretta e l'inversa) dipendono dalla concentrazione molare (in mol/L) dai loro reagenti elevati ai coefficienti stechiometrici. Da queste osservazioni sono riusciti a trovare la formula per la costante di equilibrio.
Secondo questa legge, per qualsiasi reazione chimica reversibile che raggiunge l'equilibrio,
“... La relazione tra il prodotto delle concentrazioni molari dei prodotti sollevati ai loro coefficienti stechiometrici e il prodotto delle concentrazioni molari dei reagenti sollevati ai loro coefficienti stechiometrici è costante ad una certa temperatura."
Questa costante è chiamata "costante di equilibrio" ed è rappresentata con il simbolo kC.
La formula costante di equilibrio
Vediamo come appare l'affermazione precedente sotto forma di un'equazione matematica. È una reazione chimica reversibile come quella presentata di seguito, in cui A e B sono i reagenti, C e D i prodotti e A, B, C e D sono i rispettivi coefficienti stechiometrici della reazione equilibrata:
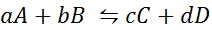
Per una reazione generica come questa, la costante di equilibrio è data da:
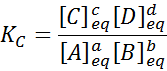
dove [a], [b], [c] e [d] sono le concentrazioni molari di a, b, c e d in equilibrio.
Il saldo costante nelle pressioni
La formula precedente per la costante di equilibrio si applica a qualsiasi reazione chimica in cui tutte le sostanze sono nella stessa fase (cioè che sono tutte in fase acquosa o in una fase gassosa, per esempio). Tuttavia, nel caso delle reazioni della fase gassosa, è più conveniente lavorare con le pressioni che con le concentrazioni.
Poiché la concentrazione molare dei gas è proporzionale alla loro pressione parziale, la formula della costante di equilibrio può essere riscritta in termini di queste pressioni, come segue:
Può servirti: 30 usi di acidi carbossilici nella vita di tutti i giorni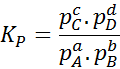
Dove pA, PB, PC E pD Sono le pressioni parziali di A, B, C e D rispettivamente e A, B, C e D rimangono i coefficienti stechiometrici. In questo caso, kP Si chiama costante equilibrio nelle pressioni ed è correlato a kC Attraverso la seguente formula:
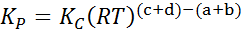
dove r è la costante universale dei gas ideali e T è la temperatura assoluta in Kelvin.
Reazioni che coinvolgono più di una fase
A volte, una reazione chimica comporta la formazione di un solido come precipitato da una soluzione o la formazione di un liquido da reagenti che reagiscono in una fase gassosa. In questi casi, la reazione non sta avvenendo nella stessa fase, quindi dobbiamo modificare la formula costante di equilibrio.
Fortunatamente, le modifiche sono molto semplici. L'unica cosa che dobbiamo prendere in considerazione quando si scrive la formula della costante di equilibrio è che le sostanze pure che appaiono come solidi o liquidi non dovrebbero tenerle in considerazione. Se necessario, invece posizioniamo un 1.
In conclusione, la legge sull'azione di massa consente di scrivere la formula della costante di equilibrio sia in concentrazioni che in pressioni parziali. Dopo aver conosciuto uno dei due, l'altro può essere trovato dal primo.
Infine, dobbiamo fare attenzione e rivedere la fase in cui si trovano tutte le specie chimiche, per sapere se dobbiamo includerle o meno nella costante di equilibrio.
Esempi dell'uso della legge sull'azione di massa
Nei seguenti esempi mostriamo come utilizzare la legge sull'azione di massa per scrivere le formule di costanti di equilibrio per diversi tipi di reazioni chimiche.
Reazioni di reazioni nello stato gassoso
Esempio 1: la decomposizione di n2O4 in una fase gassosa
Poi2O4 È un gas marrone che si rompe in base alla seguente reazione:
Può servirti: acido láuric: struttura, proprietà, usi, benefici, effetti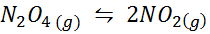
 Campione NO2 a temperature diverse che mostrano lo spostamento dell'equilibrio per il marrone N2O4
Campione NO2 a temperature diverse che mostrano lo spostamento dell'equilibrio per il marrone N2O4 Per questa reazione, le costanti di equilibrio in concentrazioni e pressioni sono fornite da:
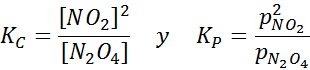
Esempio 2: l'ossidazione del monossido di carbonio
Il monossido di carbonio è un gas molto tossico che può diventare anidride carbonica quando reagisce con ossigeno secondo la seguente reazione:
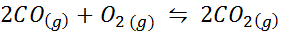
Per questa reazione, le costanti di equilibrio in concentrazioni e pressioni sono fornite da:
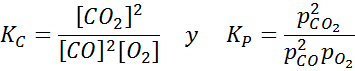
Base acidi in fase acquosa
ESEMPIO 3: Auto -lunghezza dell'acqua
L'equilibrio ionico dell'acqua, noto anche come reazione di lunghezza di sé dell'acqua, è una reazione reversibile tra due molecole d'acqua in uno stato liquido. La reazione è:
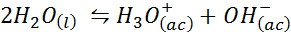
Quando si scrive la costante di equilibrio per questa reazione, dobbiamo tenere conto che, in questo caso, l'unico reagente è un liquido puro la cui concentrazione è praticamente costante. Per questo motivo, non è incluso nella formula della costante di equilibrio:
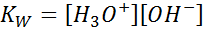
Questa è una costante di equilibrio molto importante che riceve il proprio nome (costante del prodotto ionico dell'acqua) e il proprio simbolo (kW. W si riferisce all'acqua in inglese, che si dice toilette). Tuttavia, è una costante equilibrio in concentrazioni come qualsiasi altro.
Saluti di solubilità
Esempio 4: equilibrio di solubilità del cloruro d'argento
Quando prepariamo una soluzione satura, viene stabilito un equilibrio di solubilità. In questo caso, l'equilibrio è quello della dissoluzione del cloruro d'argento, la cui reazione è data da:
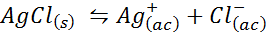
La costante di equilibrio di questa reazione (e di tutte le reazioni della soluzione) non include cloruro d'argento (AGCL) poiché è solido. Inoltre, come nel caso dell'acqua, queste costanti ricevono anche un nome speciale che è "costante del prodotto di solubilità", rappresentato come K$: