Funzioni LDH, determinazione, reazione, valori normali
- 3604
- 1022
- Cosetta Messina
IL lattato deidrogenasi, L'acido lattico deidrogenasi, la dipendente dipendente dalla NAD lattata o semplicemente LDH, è un enzima appartenente al gruppo di ossidorticas che si trova praticamente in tutti i tessuti animali, verdure e in molti microrganismi come batteri, lieviti e archi.
Gli enzimi di questo tipo sono indicati con il numero EC 1.1.1.27 del comitato di nomenclatura enzimatica e sono responsabili della reazione che converte il lattato in piruvato (per ossidazione) e viceversa (mediante riduzione), ossidando o riducendo i dyucleotidi della nicotinamide adenina (NAD+ e NADH) nel processo noto come fermentazione lattica di fermentazione lattica.
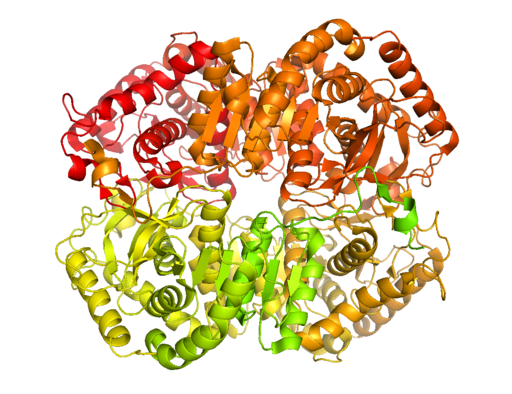
 Struttura cristallina della lattata deidrogenasi B (fonte: BCDOYE [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Struttura cristallina della lattata deidrogenasi B (fonte: BCDOYE [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) A differenza della fermentazione alcolica, che si verifica solo in alcuni microrganismi come lieviti e uso.
Questo importante enzima per il metabolismo cellulare è stato cristallizzato dal muscolo del ratto scheletrico negli anni '40 e, ad oggi, i più caratterizzati sono quello del muscolo scheletrico e del tessuto cardiaco nei mammiferi.
Negli animali "superiori" l'enzima usa l'isomero L lattato (L-lattato) per la produzione di piruvato, ma alcuni animali e batteri "inferiori" producono d-lattato dal piruvato ottenuto dalla glicolisi.
Il lattato deidrogenasi è generalmente espresso principalmente nei tessuti o nelle cellule in condizioni anaerobiche (bassa irrigazione del sangue) che, nell'uomo, ad esempio, possono caratterizzare condizioni patologiche come cancro, epatiche o condizioni cardiache.
Tuttavia, la conversione del piruvato in lattato è tipica dei muscoli durante l'esercizio e della cornea dell'occhio, che è scarsamente ossigenato.
[TOC]
Funzioni
Lattato deidrogenasi incontra molteplici funzioni su numerosi percorsi metabolici. È il centro del delicato equilibrio tra le rotte cataboliche e anaboliche dei carboidrati.
Durante la glicolisi aerobica, piruvato (l'ultimo prodotto del percorso di per sé) Può essere usato come substrato del complesso enzimatico piruvato deidrogenasi, da cui è decarbossilato, liberando molecole di acetil-CoA che vengono utilizzate a valle, metabolicamente parlando, nel ciclo di Krebs.
Nella glicolisi anaerobica, al contrario, l'ultima fase della glicolisi produce piruvato, ma questo viene utilizzato dal lattato deidrogenasi per produrre lattato e NAD+, che ripristina il NAD+ che è stato usato durante la reazione catalizzata dalla gliceraldeide 3-fosfato deidrogenasi.
Come durante l'anaerobiosi la principale fonte di produzione di energia sotto forma di ATP è la glicolisi, il lattato deidrogenasi ha un ruolo fondamentale nella reossidazione del NADH prodotto nelle precedenti passaggi della via glicolitica, essenziale per il funzionamento di altri enzimi correlati.
Può servirti: tubulinaIl lattato deidrogenasi è anche coinvolto nella glicogenesi che si svolge nei tessuti che convertono il lattato in glicogeno e, in alcuni tessuti aerobici come il cuore, il lattato è un combusti+, rispettivamente.
Caratteristiche e struttura
Esistono più forme molecolari di lattato deidrogenasi in natura. Solo negli animali è stato determinato che ci sono cinque attività lattate deidrogenasi, tutte tetramericer e essenzialmente composte da due tipi di catene polipeptidiche note come le subunità H e M (poter essere omo o eterotramérica).
La forma H è in genere in tessuto cardiaco, mentre la forma M è stata rilevata nel muscolo scheletrico. Entrambe le catene differiscono l'una dall'altra in termini di abbondanza, composizione di aminoacidi, proprietà cinetiche e proprietà strutturali.
Le forme H e M sono il prodotto traslazionale di diversi geni, possibilmente situati in diversi cromosomi e che sono anche sotto il controllo o la regolazione di diversi geni. La forma H è predominante nei tessuti con metabolismo aerobico e la forma M nei tessuti anaerobici.
Un altro tipo di nomenclatura utilizza le lettere A, B e C per i diversi tipi di enzimi sia nei mammiferi che negli uccelli. Pertanto, il muscolo deidrogenasi del lattato è noto come4, cardiaco come b4 e un terzo si chiama C4, che è specifico per i testicoli.
L'espressione di questi isoenzimi è regolata sia in una forma di sviluppo-dipendente che dipendente dai tessuti.
L'enzima è stato isolato da diverse fonti animali ed è stato stabilito che la sua struttura tetramericana ha un peso molecolare medio di circa 140 kDa e che il sito dell'Unione per NADH o NAD+ È costituito da un foglio di β-pedie composto da sei catene e 4 eliche alfa.
Determinazione
Mediante spettrofotometria
L'attività del lattato deidrogenasi dell'origine animale è alcune spettrofotometricamente In vitro attraverso le misurazioni del cambiamento di colorazione grazie al processo di ossidorrezione che si svolge durante la reazione di conversione del piruvato in lattato.
Le misurazioni sono effettuate a 340 nm con uno spettrofotometro e viene determinato il tasso di diminuzione della densità ottica dovuta all'ossidazione o alla "scomparsa" di NADH, che viene convertita in NAD+.
Cioè, la reazione determinata è la seguente:
Piruvato + nadh + h+ → Lattato + NAD+
La misurazione enzimatica dovrebbe essere eseguita in condizioni di pH ottimali e la concentrazione di substrati per l'enzima, in modo che il rischio di sottovalutare la quantità presente nei campioni a causa del deficit del substrato o da condizioni estreme di acidità o basicità.
Mediante immunohistochimica
Un altro metodo, forse in qualche modo più moderno, poiché la determinazione della presenza di lattata deidrogenasi ha a che fare con l'uso di strumenti immunologici, cioè con l'uso di anticorpi.
Può servirti: omologia (biologia)Questi metodi sfruttano l'affinità tra l'unione di un antigene con un anticorpo generato specificamente contro di esso e sono molto utili per la rapida determinazione della presenza o dell'assenza di enzimi come LDH in un particolare tessuto.
A seconda dello scopo, gli anticorpi utilizzati devono essere specifici per la rilevazione di uno qualsiasi degli isoenzimi o per qualsiasi proteina con il lattato di attività deidrogenasi.
Perché determinare lattata deidrogenasi?
La determinazione di questo enzima viene eseguita con scopi diversi, ma principalmente per la diagnosi clinica di alcune condizioni, tra cui l'infarto miocardico e il cancro.
A livello cellulare, il rilascio del lattato deidrogenasi è stato considerato uno dei parametri per determinare il verificarsi di processi necrotici o apoptotici, poiché la membrana plasmatica diventa permeabile.
I prodotti della reazione secondo cui Catalyz può anche essere determinato in un tessuto per determinare se un metabolismo anaerobico predomina per qualche motivo speciale.
Reazione
Come inizialmente commentato, l'enzima lattato deidrogenasi, il cui nome sistematico è (S) -Lattato: NAD+ deidrogenasi, conversione del lattato catalizzatore in un piruvato+ dipendente, o viceversa, che si verifica grazie al trasferimento di uno ione idruro (H-) Dal piruvato al lattato o da NADH al piruvato ossidato.
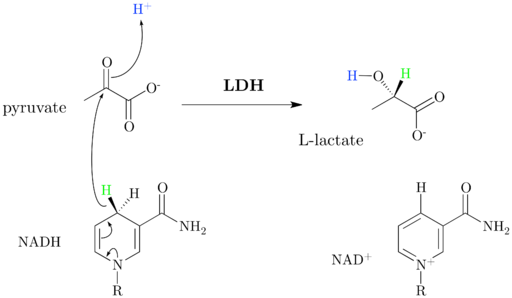 Schema e meccanismo di reazione del lattato deidrogenasi (fonte: jazzlw [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Schema e meccanismo di reazione del lattato deidrogenasi (fonte: jazzlw [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) Il NAD+ Ha un'unità ADP e un altro gruppo nucleotico derivato da acido nicotinico, chiamato anche niacina o vitamina B3, E questo coenzima partecipa a molteplici reazioni di grande importanza biologica.
È importante evidenziare che l'equilibrio in questa reazione viene spostato al lato corrispondente al lattato ed è stato dimostrato che l'enzima è anche in grado di ossidare altri acidi (S) -2 -idrossimonocarbossilico e uso, sebbene meno efficiente, NADP+ come substrato.
A seconda della regione del corpo considerata e, allo stesso tempo, delle sue caratteristiche metaboliche in relazione alla presenza o all'assenza di ossigeno, i tessuti producono diverse quantità di lattato, il prodotto della reazione catalizzata dal LDH.
Se, ad esempio, un globulo rosso (eritrocita) che manca di mitocondri che può metabolizzare il piruvato prodotto durante la glicolisi in CO2 E acqua, quindi si potrebbe dire che queste sono le principali cellule che producono il lattato nel corpo umano, poiché tutto il piruvato viene convertito in lattato dall'azione del lattato deidrogenasi.
D'altra parte, se vengono prese in considerazione le cellule epatiche e le cellule del muscolo scheletrico, questi sono responsabili della produzione di una quantità minima di lattato, in considerazione del fatto che questo è rapidamente metabolizzato.
Può servirti: sabouraud agar: cosa è, fondazione, preparazione, usiValori normali
La concentrazione di lattato deidrogenasi nel siero del sangue è il prodotto dell'espressione di diversi isoenzimi nel fegato, nel cuore, nel muscolo scheletrico, negli eritrociti e nei tumori, tra gli altri.
Nel siero del sangue le gamme normali di attività del lattato deidrogenasi sono comprese tra 260 e 850 U/mL (unità per millilitro), con un valore medio di 470 ± 130 U/ml. Nel frattempo, quelli emoralizzati nel sangue hanno un'attività LDH che varia tra 16.000 e 67.000 u/ml, che equivale a una media di 34.000 ± 12.000 u/ml.
Cosa significa avere un LDH alto?
La quantificazione della concentrazione di lattato deidrogenasi nel siero del sangue ha un valore importante nella diagnosi di un po 'di cuore, fegato, malattie del sangue e persino tumori.
Alte cifre di attività LDH sono state riscontrate in pazienti con infarti miocardici (sia sperimentali che clinici), nonché in pazienti cancerosi, in particolare nelle donne con carcinoma endometriale, ovaie, mammella e utero.
A seconda del particolare isoenzima che è in "eccesso" o in un'alta concentrazione, la quantificazione degli isoenzimi del lattato deidrogenasi viene utilizzato da molti medici trattanti per la determinazione delle lesioni ai tessuti (gravi o cronici).
Riferimenti
- Bergmeyer, h., Piegato, e., & Hess, B. (1961). Deidrogenasi lattica. Metodi di analisi enzimatica. Seelag Chemie, GmbH.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Organizzazione genomica del gene lattato deidrogenasi-A. Diario biochimico, 231, 537-541.
- Becker, d. (2003). Acidosi lattica. Med di terapia intensiva, 29, 699-702.
- Anche, j., & Kaplan, N. (1973). Disidrogesi del lattato: struttura e funzione. In Progressi nell'enzimologia e aree correlate della biologia molecolare (pp. 61-133).
- Fox, s. Yo. (2006). Fisiologia umana (9 ° ed.). New York, USA: McGraw-Hill Press.
- Huijgen, h., Sanders, g. T. B., Koster, r. W., Vreeken, J., & Bossuyt, P. M. M. (1997). Il valore clinico del lattato deidrogenasi nel siero: una revisione quantitativa. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Comitato nomenclatura dell'Unione internazionale di biochimica e biologia molecolare (NC-IBMB). (2019). Estratto da www.Qmul.AC.UK/SBCS/IUBMB/Enzyme/Index.Html
- Rawn, j. D. (1998). Biochimica. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-Bomez, m., Wicks, r. W., & Warshaw, M. (1979). Determinazione immunochimica dell'isoenzima cardiaco della lattata deidrogenasi (LDH1) nel siero umano. Clin Chem, 25(5), 729-734.
- Wróblewski, f., & Ladue, J. S. (1955). Attività della degidrogrogenasi lattica nel sangue. Biologia sperimentale e medicina, 90, 210-215.
- « Caratteristiche di Páramo, tipi, flora, fauna, esempi
- Apolipoproteina e caratteristiche, funzioni, malattie »

