Interazioni idrofobiche ciò che è, importanza, esempi
- 3952
- 730
- Brigitta Ferrari
IL Interazioni idrofobiche (HI) Sono le forze che mantengono la coesione tra composti apolari immersi in una soluzione polare o solvente. A differenza di altre interazioni non covalenti, come ponti idrogeno, interazioni ioniche o forze di van der Waals, le interazioni idrofobiche non dipendono dalle proprietà intrinseche dei soluti, ma piuttosto dai solventi.
Un esempio molto illustrativo di queste interazioni può essere la separazione di fase che si verifica quando si tratta di miscelare l'acqua con l'olio. In questo caso, le molecole di petrolio "interagiscono" tra loro a causa dell'ordinamento delle molecole d'acqua intorno a loro.
 Emulsione del grasso in acqua (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons)
Emulsione del grasso in acqua (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons) La nozione di queste interazioni esiste da prima degli anni Quaranta. Tuttavia, il termine "legame idrofobico" fu coniato da Kauzmann nel 1959, mentre studiava i fattori più importanti nella stabilizzazione della struttura tridimensionale di alcune proteine.
Le sue sono le interazioni non specifiche più importanti che si svolgono nei sistemi biologici. Hanno anche un ruolo importante in una varietà di applicazioni ingegneristiche e nell'industria chimica e farmaceutica che conosciamo oggi.
Causa delle interazioni idrofobiche
La sua causa fisica si basa sull'incapacità delle sostanze apolari di formare legami idrogeno con molecole d'acqua in una soluzione.
Sono conosciuti come "interazioni non specifiche" poiché non sono correlate all'affinità tra molecole di soluto, ma piuttosto alla tendenza delle molecole d'acqua a mantenere le proprie interazioni mediante legami idrogeno.
Può servirti: biosurfattantiAl contatto con l'acqua, le molecole apolari o idrofobiche tendono ad aggiungere spontaneamente, per ottenere una maggiore stabilità riducendo l'area della superficie di contatto con acqua.
Questo effetto potrebbe essere confuso con una forte attrazione, ma non è altro che una conseguenza del carattere apolare delle sostanze in relazione al solvente.
Spiegati da un punto di vista termodinamico, queste associazioni spontanee si verificano alla ricerca di uno stato energeticamente favorevole, in cui si ha la variazione di energia meno libera (∆G).
Tenendo conto che ∆G = ∆H - T∆S, Lo stato più energicamente favorevole sarà quello in cui entropia (∆S) Sii maggiore, cioè dove ci sono meno molecole d'acqua la cui libertà rotazionale e traslazionale è ridotta dal contatto con un soluto apolare.
Quando le molecole apolari sono associate tra loro, forzate da molecole d'acqua, si ottiene uno stato più favorevole che se queste molecole rimanessero separate, ciascuna circondata da una "gabbia" di diverse molecole d'acqua.
Importanza biologica
Ha una grande rilevanza, poiché si verificano nella diversità dei processi biochimici.
Tra questi processi ci sono i cambiamenti conformazionali nelle proteine, l'unione dei substrati enzimatici, l'associazione di subunità di complessi enzimatici, l'aggregazione e la formazione di membrane biologiche, la stabilizzazione delle proteine e altre soluzioni acquose.
In termini quantitativi, autori diversi hanno dato il compito di determinare quale sia l'importanza di sua nella stabilità della struttura di grandi quantità di proteine, concludendo che queste interazioni contribuiscono a oltre il 50 %.
Può servirti: glucosio ossidasi: caratteristiche, struttura, funzioniMolte proteine della membrana (integrale e periferica) sono associate a doppi strati lipidici grazie a HI quando, nelle loro strutture, queste proteine hanno domini idrofobici. Inoltre, la stabilità della struttura terziaria di molte proteine solubili dipende da HI.
Alcune tecniche nello studio della biologia cellulare sfruttano la proprietà che alcuni detergenti ionici pos.
I micel sono anche usati in studi farmaceutici che comportano la consegna di farmaci solubili in grasso e la loro formazione è anche essenziale per l'assorbimento di vitamine e lipidi complessi nel corpo umano.
Esempi di interazioni idrofobiche
Membrane
Un eccellente esempio di HI è la formazione di membrane cellulari. Tali strutture sono composte da un doppio strato di fosfolipidi. La tua organizzazione viene data grazie al suo che si verifica tra le code apolari in "repulsione" all'ambiente acquoso circostante.
Proteine
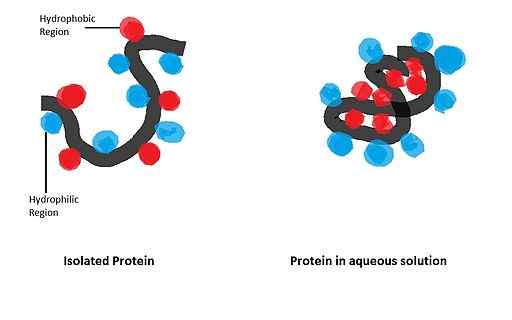
Ha una grande influenza sulla piegatura delle proteine globulari, la cui forma biologicamente attiva è ottenuta dopo l'istituzione di una particolare configurazione spaziale, governata dalla presenza di alcuni rifiuti di aminoacidi nella struttura.
- Il caso di apomioglobin
L'apomicoglobina (mioglobina priva del gruppo Hemo) è una piccola proteina alfa elicoidale che è servita da modello per studiare il processo di piegatura e l'importanza del suo tra i rifiuti apolari nella catena del polipeptide della stessa.
In uno studio condotto da Dyson e collaboratori nel 2006 in cui sono state utilizzate sequenze mutate di apomioglobina, è stato dimostrato che l'inizio degli eventi pieghevoli dipende principalmente dai suoi tra aminoacidi con gruppi apolari di elico alfa.
Può servirti: relazione tra materia ed energia osservata nella nutrizione cellularePertanto, piccoli cambiamenti introdotti nella sequenza di aminoacidi significano importanti modifiche nella struttura terziaria, che si traducono in proteine scarsamente formate e inattive.
Detergenti
Un altro chiaro esempio è la modalità di azione dei detergenti commerciali che utilizziamo per scopi domestici ogni giorno.
I detergenti sono molecole anfipatiche (con una regione polare e un altro apolare). Possono "emulsionare" il grasso poiché hanno la capacità di formare legami idrogeno con molecole d'acqua e avere interazioni idrofobiche con i lipidi presenti nei grassi.
Al contatto con il grasso in una soluzione acquosa, le molecole detergenti sono associate tra loro in modo tale che le code apolari facciano, racchiudendo le molecole lipidiche e sono esposte alla superficie della Mycela le regioni polari, che entrano nel contatto con l'acqua.
Riferimenti
- Chandler, d. (2005). Interfacce e la forza trainante del gruppo idrofobico. Natura, 437(7059), 640-647.
- Dyson, J. H., Wright, p. E., & Sheraga, H. A. (2006). Il ruolo delle interazioni idrofobiche nell'iniziazione e nella propagazione del ripiegamento delle proteine. PNA, 103(35), 13057-13061.

