Struttura ciclica di idrocarburi, proprietà, esempi
- 3473
- 656
- Lino Lombardi
IL idrocarburi ciclici Sono composti organici costituiti da atomi di carbonio e idrogeno collegati a causare anelli o strutture cicliche. Esistono principalmente tre tipi: alicomia, aromatica e policiclica.
Questi tipi di idrocarburi possono quindi consistere nelle versioni chiuse di alcani, alcheni e alchini; avere anelli con sistemi aromatici, come il benzene e i suoi derivati; o presentare strutture intricate e affascinanti. Di tutti loro gli aliciclici sono i più semplici e di solito sono rappresentati usando i poligoni.
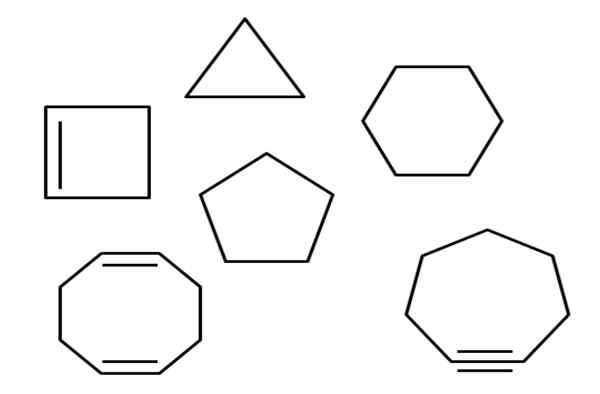
 Idrocarburi aliciclici. Fonte: Gabriel Bolívar.
Idrocarburi aliciclici. Fonte: Gabriel Bolívar. Sopra, ad esempio, ci sono diversi idrocarburi aliciclici. Sembrano semplici poligoni: un quadrato, triangolo, pentagono, esagono, ecc. Se uno dei suoi collegamenti C-C potesse essere tagliato con le forbici, il risultato sarebbe un alcano, alchene (se ha doppi collegamenti) o Alquino (se hai le triple link).
Le sue proprietà non differiscono troppo dagli idrocarburi a catena aperta da cui procedono; Sebbene, chimicamente, più grandi, più stabili saranno e la sua interazione con un mezzo molecolare diventa la più pronunciata (per la sua più grande area di contatto).
[TOC]
Struttura
Andando dritto alla questione che riguarda le loro strutture, si dovrebbe chiarire che non sono piatti, anche quando nella loro rappresentazione di poligoni sembrano così. L'unica eccezione a questa affermazione si trova nel ciclopropano.
È inoltre necessario chiarire che i termini "cicli" e "anelli" sono spesso intercambiabili; Un anello non deve circolare e quindi può acquisire geometrie infinite fintanto che è una struttura chiusa. Si dice quindi che il ciclopropano ha un anello o un ciclo triangolare.
Tutti i carboni hanno ibridazioni SP3, Quindi le loro geometrie sono tetraedri e i loro collegamenti devono essere idealmente separati da un angolo di 109,5 °; Tuttavia, ciò non è possibile per le strutture chiuse come quelle del ciclobutano (quadrato) o ciclopentano (Pentagono).
Può servirti: benzimidazolo (C7H6N2): storia, struttura, vantaggi, svantaggiSi parla quindi di una tensione che destabilizza la molecola ed è determinato sperimentalmente dalla misurazione dei calcoli di combustione media di ciascun gruppo2.
Conformazioni
E cosa succede quando ci sono collegamenti doppi o tripli? La tensione aumenta, perché dove ce n'è uno, la struttura sarà costretta a "restringersi" e rimanere piatta; che, consecutivamente, costringerebbe una conformazione sopra gli altri, probabilmente eclissando gli atomi di idrogeno vicini.
 Conformatori per il cicloesano. Fonte: sponk [dominio pubblico]
Conformatori per il cicloesano. Fonte: sponk [dominio pubblico] Nell'immagine superiore due configurazioni per il cicloesano sono mostrati per provare a spiegare quanto sopra. Gli atomi che si trovano nelle posizioni A O E Si dice che siano assiali o equatoriali, rispettivamente. Nota che invece di un esagono piatto, hai una sedia (a sinistra) e una barca (a destra).
Queste strutture sono dinamiche e stabiliscono un equilibrio tra loro. Se gli atomi in A Sono molto voluminosi, l'anello "si adatta" a posizionarli in posizioni equatoriali; Dal momento che lì sono orientati verso i lati dell'anello (che rafforzerebbero o danneggerebbero le interazioni intermolecolari).
Se osserviamo ogni carbonio separatamente, si vedrà che sono tetraedri. Questo non sarebbe così se ci fosse un doppio legame: le sue ibridazioni SP2 avrebbero costretto la struttura ad appiattire; e avere un triplo collegamento, per allineare. La struttura piatta del benzene è la massima rappresentazione di questo.
Proprietà
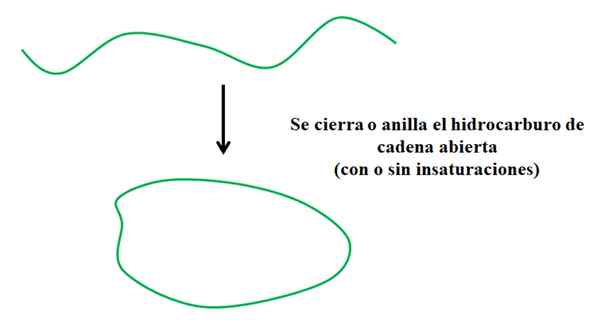 Processo semplificato in cui si forma un idrocarburo ciclico. Fonte: Gabriel Bolívar.
Processo semplificato in cui si forma un idrocarburo ciclico. Fonte: Gabriel Bolívar. Supponiamo di avere un idrocarburo a catena aperta (con o senza insaturazione o ramificazioni). Se potessimo unirci alle loro estremità, verrebbero creato un anello o un ciclo (come nell'immagine superiore).
Dall'ottica di sintesi organica, questo non accade più; Ci devono essere buoni gruppi in uscita collegati alle estremità della catena, che durante la partenza, promuovono che la catena si chiude (se la soluzione è molto diluita).
Può servirti: heptano (c7h16): struttura, proprietà e usiCon questo in mente, si può vedere che l'idrocarburo di ictus verde subisce solo una trasformazione rispetto alla sua struttura; Senza la rottura o l'aggiunta di nuovi collegamenti con altri atomi. Significa che chimicamente continua ad essere lo stesso prima e dopo la chiusura o il squillo.
Pertanto, le proprietà chimiche o fisiche di questi alcilici idrocarburi non differiscono troppo da quelli delle loro controparti a catena aperta. Entrambi sono reagenti alla stessa specie (a dirlo, gli alogeni sotto la luce utravioletta) e possono subire forti ossidazioni o combustione rilasciando.
Forze intermolecolari
C'è un fatto innegabile: l'anello ha un'area di contatto maggiore rispetto alla catena aperta, e quindi le sue interazioni intermolecolari sono più forti.
Il risultato è che i suoi punti di ebollizione e fusione tendono ad essere maggiori, proprio come le loro densità. Molte tante differenze possono essere notate nelle loro velocità di rifrazione o nelle pressioni a vapore.
Nomenclatura
Tornando all'esempio dell'idrocarburo della corsa verde, la sua nomenclatura rimane invariata una volta che si è chiusa su se stessa (come un serpente che morde la propria coda). Pertanto, le regole di nomenclatura rimangono le stesse; A meno che non vengano affrontati idrocarburi policiclici o aromatici.
Di seguito sono riportati tre composti, che verranno dati i loro nomi appropriati:
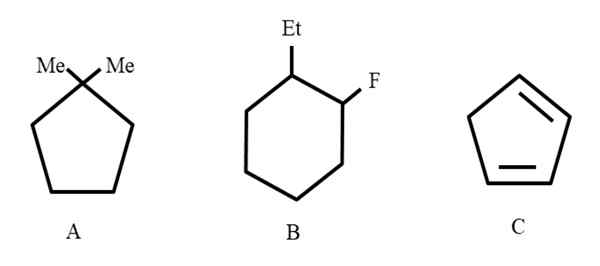 Tre esempi di idrocarburi ciclici per assegnare le loro nomenclature. Fonte: Gabriel Bolívar.
Tre esempi di idrocarburi ciclici per assegnare le loro nomenclature. Fonte: Gabriel Bolívar. Per cominciare, quando sono strutture chiuse, il ciclo del prefisso viene utilizzato per fare riferimento a loro (qui l'anello di parole è relegato).
Da sinistra a destra abbiamo: un ciclopentano, un cicloesano e un altro ciclopentano. I carboni sono elencati in modo tale che i numeri minori siano assegnati ai sostituti e sono anche menzionati in ordine alfabetico.
Può servirti: Renio: scoperta, proprietà, struttura, usiQuindi, diventa: 1.1-dimetilciclopentano. In b inizia menzionando il sostituente etilico prima del fluoro, quindi il suo nome è: 1-etil-2-fluorciclohexano. E poi per C, i doppi legami sono presi come sostituenti, il numero di carboni che ne formano devono essere indicati: 1.3-ciclopentadieno.
Esempi
Nel corso dell'articolo è stato menzionato diversi idrocarburi ciclici. Nella prima immagine possono essere trovati: cicloopropan, ciclobutano, ciclopentano, cicloesano, cicloeptano e ciclooctano.
Da loro può essere ottenuta una vasta gamma di derivati ed è sufficiente posizionare rispettivamente collegamenti doppi o tripli per avere ciclialchi o cicloaldicini,. E rispetto agli idrocarburi aromatici, è sufficiente tenere presente l'anello del benzene e sostituirlo o riprodurlo in due dimensioni.
Tuttavia, i più straordinari (e problematici quando si capiscono la loro nomenclatura) sono idrocarburi policiclici; Cioè, non è sufficiente con i poligoni semplici anche per rappresentarli in modo semplice. Tre di loro che vale la pena menzionare sono: cubano, cestino e pagodano (immagini inferiori).
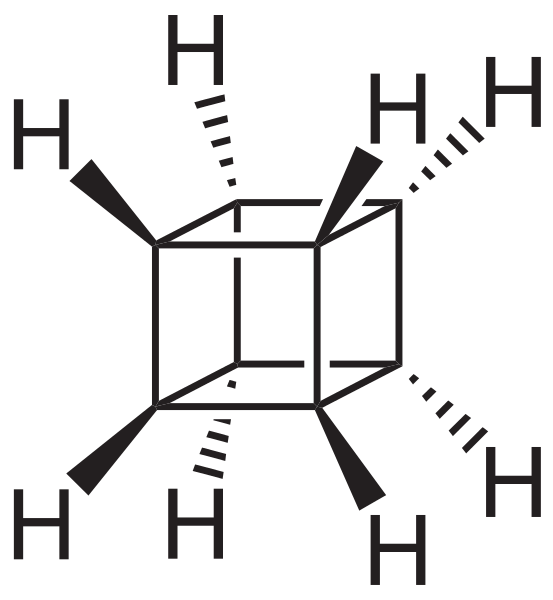 Scheletro cubano. Fonte: Neurotoger [dominio pubblico].
Scheletro cubano. Fonte: Neurotoger [dominio pubblico].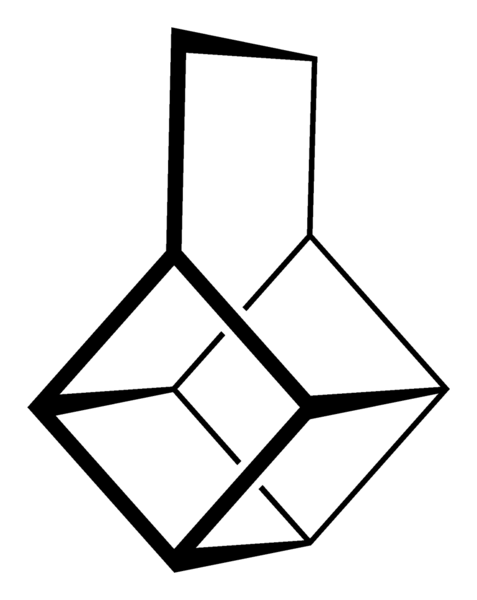 Canastano scheletro. Fonte: Benjah-BMM27 [dominio pubblico].
Canastano scheletro. Fonte: Benjah-BMM27 [dominio pubblico]. Pagodano scheletro. Fonte: Puppy8800 [dominio pubblico]
Pagodano scheletro. Fonte: Puppy8800 [dominio pubblico]
Ognuno di essi ha la sua complessa metodologia di sintesi, la loro storia, l'arte e un fascino latente per le infinite possibilità strutturali a cui possono raggiungere semplici idrocarburi.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Reid Danielle. (2019). Idrocarburi ciclici: definizione ed esempio. Studio. Recuperato da: studio.com
- Fondazione CK-12. (5 giugno 2019). Idrocarburi ciclici. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Wikipedia. (2019). Composto ciclico. Recuperato da: in.Wikipedia.org
- Miguel Cowboy. (2019). Idrocarburi ciclici. Recuperato da: Dedias.netto
- « Meccanismi di corrosione galvanica, esempi, protezione
- Storia della totipotenzialità, caratteristiche e importanza »

