Ibridazione chimica
- 1968
- 518
- Dante Morelli
Cos'è l'ibridazione chimica?
IL Ibridazione chimica È la "miscela" degli orbitali atomici, il cui concetto fu introdotto dal chimico Linus Pauling nel 1931 per coprire le imperfezioni della teoria dei collegamenti di Valencia (TEV). Quali imperfezioni? Questi sono: geometrie molecolari e collegamenti equivalenti in molecole come il metano (CH4).
Secondo il TEV, in metano gli orbitali atomici di C formano quattro collegamenti σ con quattro atomi H. Gli orbitali 2p, con forme di ∞ (immagine inferiore) della C sono perpendicolari l'una all'altra, quindi la h dovrebbe essere rimossa l'una dall'altra ad un angolo di 90º.

Inoltre, l'orbitale 2S (sferico). Tuttavia, sperimentalmente è stato scoperto che gli angoli nel CH4 Sono 109,5º e che, inoltre, le lunghezze dei collegamenti C-H sono equivalenti.
Per spiegare questo, una combinazione di orbitali atomici originali deve essere considerata per formare quattro orbitali ibridi degenerati (di uguale energia). Qui entra in gioco l'ibridazione chimica. Come sono gli orbitali ibridi? Dipende dagli orbitali atomici che li generano. Mostrano anche una miscela delle caratteristiche elettroniche di questi.
Sp3
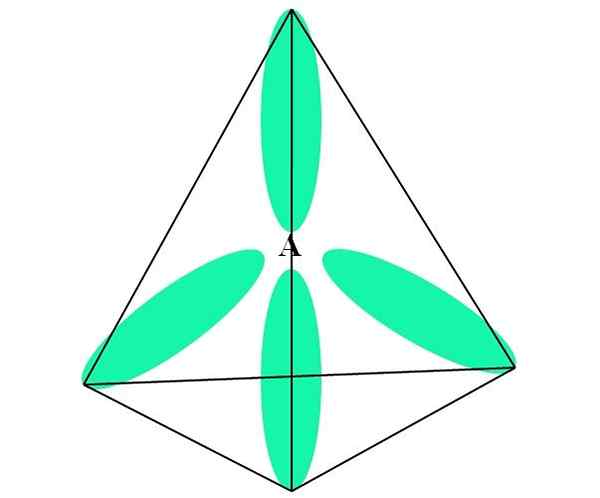
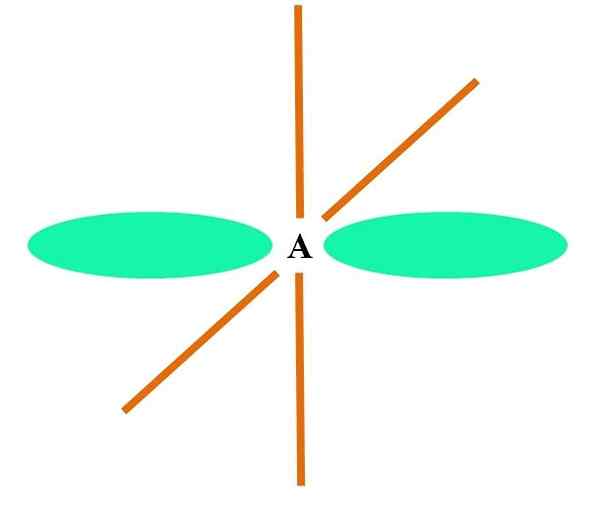
Nel caso di CH4, C ibridazione è sp3. Da questo approccio, la geometria molecolare è spiegata con quattro orbitali SP3 separato a 109,5º e indicando i vertici di un tetraedro.
Nell'immagine superiore puoi vedere come gli orbitali SP3 (verde) Stabilire un ambiente elettronico tetraedrico attorno all'atomo (A, che è C per CH4).
Può servirti: amminePerché 109,5º e non altri angoli, al fine di "disegnare" una geometria diversa? Il motivo è dovuto al fatto che questo angolo riduce al minimo le repulsioni elettroniche dei quattro atomi che sono collegati.
In questo modo, la molecola di Cho4 Può essere rappresentato come un tetraedro (geometria molecolare tetraedrica).
Se, al posto di H, il C formava collegamenti con altri gruppi di atomi, cosa sarebbe la sua ibridazione? A condizione che il carbonio moduli quattro collegamenti σ (c-A), la sua ibridazione sarà SP3.
Si può costantemente presumere che in altri composti organici come CH3Oh, CCL4, C (Ch3)4, C6H12 (Cyclohexan), ecc., Il carbonio ha un'ibridazione SP3.
Questo è essenziale per disegnare strutture organiche, in cui i carboni con semplici collegamenti rappresentano punti di divergenza; cioè, la struttura non rimane in un unico piano.
Interpretazione
Qual è l'interpretazione più semplice per questi orbitali ibridi senza affrontare gli aspetti matematici (funzioni d'onda)? The Orbitals sp3 Implicano di essere originati da quattro orbitali: uno s e tre p.
Perché la combinazione di questi orbitali atomici dovrebbe essere l'ideale, i quattro orbitali SP3 risultanti sono identici e occupano diversi orientamenti nello spazio (come negli orbitali pX, PE E pz).
Quanto sopra è applicabile per il resto delle possibili ibridazioni: il numero degli orbitali ibridi che si forma è lo stesso di quello degli orbitali atomici che si combinano. Ad esempio, SP Híbridos Orbital3D2 Sono formati da sei orbitali atomici: uno S, tre P e due D.
Deviazioni dagli angoli di collegamento
Secondo la teoria della repulsione delle coppie elettroniche dello strato di Valencia (RPECV), una coppia di elettroni liberi occupa più volume di un atomo collegato. Questo fa allontanarsi i collegamenti, diminuendo la tensione elettronica e deviando gli angoli del 109,5º:
Può servirti: crociera per crogiolo: caratteristiche, funzioni, usa esempi
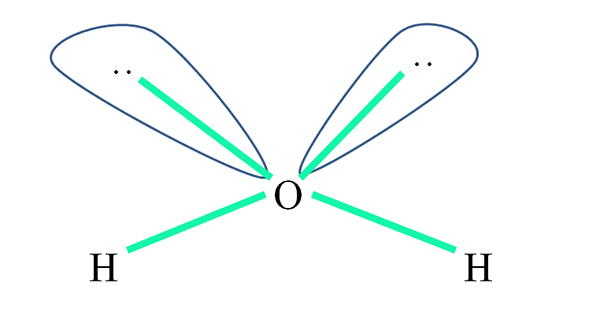
Ad esempio, nella molecola d'acqua gli atomi di H sono collegati a Orbitali SP3 (in verde), e anche le coppie di elettroni non condivisi ":" Occupano questi orbitali.
Le repulsioni di queste coppie di elettroni sono generalmente rappresentate come "due palloncini con gli occhi", che, a causa del loro volume, respingono i due collegamenti σ o-h.
Pertanto, nell'acqua gli angoli dei collegamenti sono in realtà 105º, anziché il 109,5º previsto per la geometria tetraedrica.
Cosa ha allora la geometria2O? Ha una geometria angolare. Perché? Perché mentre la geometria elettronica è tetraedrica, due coppie di elettroni non condivisi la distorcono in una geometria molecolare angolare.
Sp2
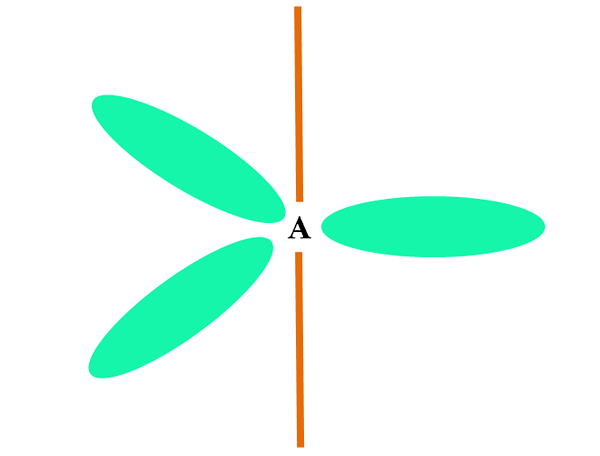
Quando un atomo combina due o S orbitali, genera tre orbitali ibridi SP2; Tuttavia, una p orbitale (perché ce ne sono tre) rimane invariata, che è rappresentata come una barra arancione nell'immagine superiore.
Qui, i tre orbitali SP2 Sono verdi per evidenziare la loro differenza dalla barra arancione: l'orbitale p "puro".
Un atomo con ibridazione SP2 Può essere visualizzato come un pavimento piatto trigonale (il triangolo disegnato con gli orbitali SP2 verde), con i suoi vertici separati da angoli a 120º e perpendicolari a una barra.
E quale ruolo gioca l'orbitale puro puro? Per formare un doppio legame (=). The Orbitals sp2 Consentono la formazione di tre collegamenti σ, mentre il legame P puro orbitale π (un collegamento doppio o triplo coinvolge uno o due collegamenti π).
Ad esempio, per disegnare il gruppo carbonilico e la struttura della molecola di formaldeide (H2C = o), continua come segue:
Può servirti: cycopropane (C3H6)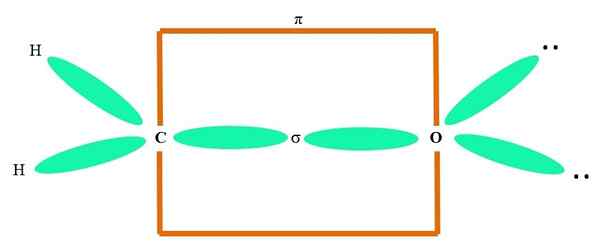
The Orbitals sp2 Sia la C che la O formano un collegamento σ, mentre i suoi puri orbitali formano un legame π (il rettangolo arancione).
Si può notare come il resto dei gruppi elettronici (atomi H e le coppie di elettroni non condivisi) si trovano negli altri orbitali2, separato da 120º.
Sp
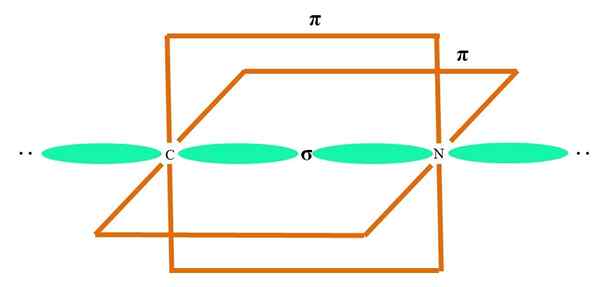
Nell'immagine superiore un atomo è illustrato con l'ibridazione SP. Qui, una s orbitale e un orbitale p. Tuttavia, due puri orbitali orbitali sono ora invariati, il che consente loro di formare due doppi collegamenti o un triplo collegamento (≡).
In altre parole: se in una struttura a C è conforme a quanto sopra (= c = o CESS. Per altri atomi meno illustrativi - come i metalli di transizione - la descrizione delle geometrie elettroniche e molecolari è complicata perché sono considerati anche gli orbitali d e persino la F.
Gli orbitali ibridi sono separati con un angolo di 180º. Per questo motivo gli atomi collegati sono disposti in una geometria molecolare lineare (B-A-B). Infine, nell'immagine inferiore si può vedere la struttura anionica del cianuro: