Funzioni di glicolisi, enzimi, fasi, prodotti, importanza
- 4626
- 677
- Kayla Serr
IL Glicolisi o La glicolisi è la principale via del catabolismo del glucosio, il cui obiettivo finale è quello di ottenere energia sotto forma di ATP e NADH riducendo il potere, da questo carboidrato.
Questa via, completamente chiarita negli anni '30 da Gustav Embden e Otto Meyerhof mentre studiano il consumo di glucosio nelle cellule muscolari scheletriche, consiste nella completa ossidazione di detto monosaccaride e, da solo, rappresenta una via anaerobica per l'ottenimento dell'energia.
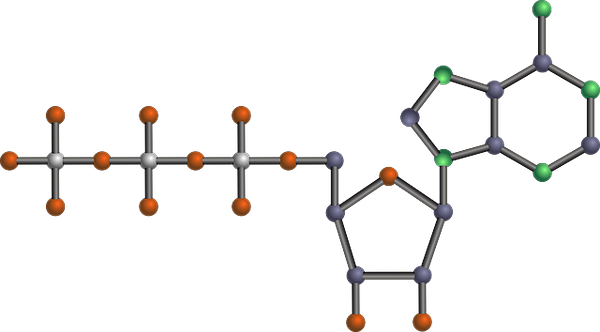
 Struttura molecolare dell'ATP, uno dei prodotti glicolitici (riassunto del percorso glicolitico (Fonte: Tekks at English Wikipedia/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) via Wikimedia Commons)
Struttura molecolare dell'ATP, uno dei prodotti glicolitici (riassunto del percorso glicolitico (Fonte: Tekks at English Wikipedia/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) via Wikimedia Commons) È una delle principali rotte metaboliche, perché si verifica, con le sue differenze, in tutti gli organismi viventi che esistono, unicellulari o multicellulari, procarioti o eucarioti, e si pensa che sia una catena di reazioni molto conservate in modo evolutivo in natura in natura.
In effetti, ci sono alcuni organismi e tipi di cellule che dipendono esclusivamente da questo percorso per sussistere.
In primo luogo, la glicolisi consiste nell'ossidazione del glucosio, di 6 atomi di carbonio, al piruvato, che ha tre atomi di carbonio; Con la concomitante produzione di ATP e NADH, utile per le cellule del punto di vista metabolico e sintetico.
In quelle cellule in grado di elaborare ulteriormente i prodotti ottenuti dal catabolismo del glucosio, la glicolisi termina con la produzione di anidride carbonica e acqua attraverso il ciclo di Krebs e la catena del trasportatore di elettroni (glicolisi aerobica).
Dieci reazioni enzimatiche si svolgono nel corso della via glicolitica e, sebbene la regolazione di queste reazioni possa essere qualcosa di diverso da una specie all'altra, i meccanismi di regolazione sono anche abbastanza conservati.
[TOC]
Funzioni di glicolisi
Dal punto di vista metabolico, il glucosio è uno dei carboidrati più importanti per tutti gli esseri viventi.
È una molecola stabile e molto solubile, quindi può essere trasportata con relativa facilità in tutto il corpo di un animale o di una pianta, da dove è immagazzinato e/o ottenuto dove è necessario come combustibile cellulare.
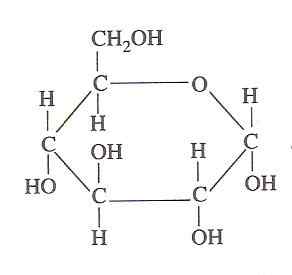 Struttura del glucosio (Fonte: Oliva93/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons)
Struttura del glucosio (Fonte: Oliva93/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) L'energia chimica contenuta nel glucosio è sfruttata dalle cellule viventi attraverso la glicolisi, che consiste in una serie di passaggi estremamente controllati con cui l'energia rilasciata dall'ossidazione di questo carboidrato in forme di energia più utilizzabili può essere "catturata", quindi la sua importanza.
Attraverso questo percorso, non solo l'energia (ATP) e la riduzione del potere (NADH), ma fornisce una serie di intermediari metabolici che fanno parte di altre rotte, anche importanti dall'anabolico (biosintetico) e dal funzionamento cellulare generale. Ecco un elenco:
- Glucosio 6-fosfato per la via del fosfato di Pentosas (PPP, inglese Pantos Mushco Pathway)
- Piruvato per fermentazione lattica
- Piruvato per sintesi di aminoacidi (alanina, principalmente)
- Piruvato per il ciclo dell'acido tricarbossilico
- 6-fosfato di fruttosio, glucosio 6-fosfato e diidrossiacetone fosfato, che funzionano come "blocchi di costruzione" su altri percorsi come la sintesi del glicogeno, acidi grassi, trigliceridi, nucleotidi, aminoacidi, ecc.
Produzione di energia
La quantità di ATP prodotta dal percorso glicolitico.
Tuttavia, quando si tratta di cellule aerobiche, la glicolisi funge anche da fonte di energia di emergenza e funge da "fase preparatoria" prima delle reazioni di fosforilazione ossidativa che caratterizzano le cellule con metabolismo aerobico.
Enzimi che partecipano alla glicolisi
La glicolisi è possibile solo grazie alla partecipazione dei 10 enzimi che catalizzano le reazioni che caratterizzano questa via. Molti di questi enzimi sono alosterici e cambiano forma o conformazione quando esercitano le loro funzioni catalitiche.
Ci sono enzimi che rompono e formano legami covalenti tra i loro substrati e ce ne sono altri che richiedono cofattori specifici per esercitare le loro funzioni, principalmente ioni metallici.
Strutturalmente parlando, tutti gli enzimi glicolitici hanno un centro essenzialmente formato dai fogli β parallelo circondato da Hellices α e ordinato in più di un dominio. Inoltre, questi enzimi sono caratterizzati perché i loro siti attivi si trovano di solito nei siti sindacali tra i domini.
È anche importante sottolineare che la principale regolazione del percorso passa attraverso il controllo (ormonale o metaboliti) di enzimi come esochinasi, fosfofrucerachinasi, gliceraldeide 3-fosfato deidrogenasi e piruvato chinasi.
Può servirti: parenchima polmonare: descrizione, istologia, malattie Punti di regolamentazione principale del percorso glicolitico.Org/licenze/by-sa/3.0) via Wikimedia Commons)
Punti di regolamentazione principale del percorso glicolitico.Org/licenze/by-sa/3.0) via Wikimedia Commons) 1- Exochinasi (HK)
La prima reazione della glicolisi (fosforilazione del glucosio) è catalizzata dall'exochinasi (HK), il cui meccanismo d'azione sembra consistere in un "aggiustamento indotto" dal substrato, che promuove la "chiusura" dell'enzima attorno all'ATP e al glucosio ( i suoi substrati) una volta che si sono uniti a questi.
A seconda dell'organismo considerato, potrebbero esserci uno o più isoenzimi, il cui peso molecolare varia tra 50 (circa 500 aminoacidi) e 100 kDa, poiché sembrano essere raggruppati sotto forma di confini, la cui formazione è favorita dai Presenza di glucosio, ioni di magnesio e ATP.
L'esochinasi ha una struttura terziaria composta da alfa e fogli beta aperti, sebbene ci siano molte differenze strutturali in questi enzimi.
2- isomerasi fosfoglucosio (PGI)
Il glucosio fosforilato mediante esochinasi è isomerizzato al fruttosio 6-fosfato mediante isomerasi fosfoglucosio (PGI), noto anche come glucosio 6-fosfato isomerasi. L'enzima, quindi, non rimuove o aggiunge atomi, ma piuttosto riordinarli a livello strutturale.
Questo è un enzima attivo nella sua forma dimorica (il monomero pesa più o meno 66 kDa) ed è coinvolto non solo nella glicolisi, ma anche nella gluconeogenesi, nella sintesi di carboidrati nelle piante, ecc.
3- fosfofrutequinasi (PFK)
Il fruttosio a 6-fosfato è substrato per l'enzima fosfofrucerachinasi, che è di nuovo in grado di fosforilazione questa molecola usando ATP come donatore di gruppo fosforil.
Questo enzima esiste nei batteri e nei mammiferi come un enzima omotramericano (composto da quattro subunità identiche di 33 kDa ciascuno per batteri e 85 kDa ciascuno nei mammiferi) e nei lieviti è un ottametro (composto da subunità più grandi, tra 112 e 118 kDa).
È un enzima alosterico, il che significa che è regolato positivamente o negativamente da uno qualsiasi dei suoi prodotti (ADP) e altre molecole come ATP e citrato.
4- aldolasi
Conosciuta anche come fruttosio 1.6-biffosfato aldolasi, l'aldolasi catalizza la rottura catalitica del fruttosio 1.6-bifosfato nel diidrossicetone fosfato e nel gliceraldeide 3-fosfato e nella reazione di reazione, cioè l'unione di entrambi gli zuccheri per la formazione della formazione di fruttoso 1.6-bifosato.
In altre parole, questo enzima taglia il fruttosio 1.6-bifosfato proprio nel mezzo, rilasciando due composti fosforilati di 3 atomi di carbonio. L'aldolasi è anche composta da 4 subunità identiche, ognuna con il proprio sito attivo.
È stata determinata l'esistenza di due classi (I e II) di questo enzima, che differiscono per il meccanismo della reazione che catalizza e perché alcuni (il primo) si verificano in batteri "più bassi" ed eucarioti e gli altri (gli altri (gli altri (gli altri (gli altri (gli altri (gli altri (gli altri (gli altri (gli altri (gli altri il secondo) sono in batteri, protisti e metazoo.
L'aldolasi degli eucarioti "superiori" è costituita da un omotermetro di subunità di 40 kDa di peso molecolare, ciascuno formato da un barile composto da 8 fogli β/α.
5- triosa-fosfato isomerasi (TIM)
I due triosas fosforilati possono essere interconvertiti tra loro grazie all'azione dell'isomerasi triosa-fosfato, che consente di utilizzare entrambi gli zuccheri durante la glicolisi, garantendo l'uso completo di ogni molecola di glucosio che entra nella strada.
Questo enzima è stato descritto come l'enzima "perfetto", perché catalizza la reazione descritta su un miliardo di volte più velocemente di quanto accada senza la sua partecipazione. Il suo sito attivo si trova al centro di una struttura beta-barili, una caratteristica di molti enzimi glicolitici.
È una proteina di dimérica, formata da due subunità identiche di circa 27 kDa, entrambe con una struttura globulare.
6- Gliceceraldeide 3-fosfato deidrogenasi (GAPDH)
Il gliceraldeide 3-fosfato prodotto dall'azione dell'isomerasi triosa-fosfato funge da substrato per il GAPDH, che è un enzima omoterramericerico (34-38 kDa ogni subunità) che cooperano cooperativamente , così come 2 ioni fosfato o solfato.
In questo passaggio del percorso, l'enzima consente la fosforilazione di uno dei suoi substrati utilizzati fosfato inorganico come donatore di gruppo fosforilico, con la concomitante riduzione di due molecole NAD+.
7- fosfoglycerato chinasi (PGK)
La chinasi della fosfoglicerazione è responsabile del trasferimento di uno dei gruppi di fosfato 1.3-bifosfoglicerate in una molecola ADP a causa della fosforilazione a livello di substrato. Questo enzima usa un meccanismo simile a quello usato dall'esochinasi, in quanto si chiude per contattare i suoi substrati, proteggendoli dalle molecole interferenziali dell'acqua.
Può servirti: aponeurosi: caratteristiche, funzioni, posizioneQuesto enzima, come altri che usano due o più substrati, ha un sito di legame per l'ADP e un altro per lo zucchero fosfato.
A differenza degli altri enzimi descritti, questa proteina è un monomero da 44 kDa con una struttura bilobulare, composta da due domini della stessa dimensione collegata da una "scanalatura" stretta.
8- fosfoglicerato mutasi
Il 3-fosfoglicerato subisce un cambiamento dal gruppo fosfato a carbonio 2, nel mezzo della molecola, che rappresenta un sito di instabilità strategica che facilita il successivo trasferimento del gruppo in una molecola ATP nell'ultima reazione della via.
Questo posteriore è catalizzato dall'enzima fosfoglicerato mutasa, un enzima di dimérica per umani e tetramericani per lieviti, con una dimensione della subunità vicino a 27 kDa.
9- enolasi
Enolasi catalizza la disidratazione del 2-fosfoglicerato a fosfoenolpiruvato, passo necessario per la generazione di ATP nella seguente reazione.
È un enzima di dimérica composto da due subunità identiche di 45 kDa. Dipende dagli ioni di magnesio per la stabilità e per il cambiamento conformazionale necessario per unirsi al substrato. È uno degli enzimi espressi con maggiore abbondanza nel citosol di molti organismi ed esercita ulteriori funzioni al glicolitico.
10- Quinasa piruvato
La seconda fosforilazione a livello di substrato che si svolge nella glicolisi è catalizzata dal piruvato della chinasi, che è responsabile del trasferimento del gruppo fosforil.
Questo enzima è più complesso di qualsiasi altro enzima glicolitico e nei mammiferi è un enzima omotramico (57 kDa/subunità). Ci sono, nei vertebrati, almeno 4 isoenzimi: L (nel fegato), R (negli eritrociti), M1 (nei muscoli e nel cervello) e M2 (tessuto fetale e tessuti adulti).
Fasi di glicolisi (passo per passo)
La via glicolitica è costituita da dieci passaggi sequenziali e inizia con una molecola di glucosio. Durante il processo, la molecola di glucosio viene "attivata" o "preparata" con l'aggiunta di due fosfati, investendo due molecole ATP.
Successivamente viene "tagliato" in due frammenti ed è infine modificato chimicamente un paio di volte, sintetizzando, sulla strada, quattro molecole ATP, quindi il guadagno netto della rotta corrisponde a due molecole ATP.
Da quanto sopra si può dedurre che il percorso è diviso in una fase di "investimento" di energia, fondamentale per la completa ossidazione della molecola di glucosio, e un'altra fase di "guadagno" di energia, in cui l'energia utilizzata inizialmente viene riempito e due ATP ATP. molecole.
- Fase di investimento energetico
1- Il primo passo della via glicolitica consiste nella fosforilazione del glucosio mediata dall'esochinasi (HK), per la quale l'enzima usa una molecola ATP per ciascuna molecola di glucosio. È una reazione irreversibile e dipende dalla presenza di ioni di magnesio (MG2+):
Glucosio + ATP → glucosio 6-fosfato + ADP
Il glucosio 2- 6-fosfato così prodotto è isomerizzato in fruttosio 6-fosfato grazie all'azione dell'enzima fosfoglucosio isomerasi (PGI) (PGI). Questa è una reazione reversibile e non implica un'ulteriore spesa energetica:
Glucosio 6-fosfato → fruttosio 6-fosfato
3- Successivamente, un'altra fase di investimento energetico implica la fosforilazione del fruttosio 6-fosfato per formare il fruttosio 1.6-bifosfato. Questa reazione è catalizzata dall'enzima fosfofrutequinasi-1 (PFK-1). Come il primo passo del percorso, la molecola di donatore del gruppo fosfato è l'ATP ed è anche una reazione irreversibile.
Fruttosio 6-fosfato + ATP → fruttosio 1.6-bifosfato + ADP
4- In questa fase di glicolisi c'è la rottura catalitica del fruttosio 1.6-bifosfato nel diidrossiacetone fosfato (DHAP) una chetosi e in gliceraldeide 3-fosfato (gap) un aldosa. Questa condensazione aldolica è catalizzata dall'enzima aldolasi ed è un processo reversibile.
Fruttosio 1.6-biffosfato → Diidrossicetone fosfato + gliceraldeide 3-fosfato
5- L'ultima reazione della fase di investimento energetico consiste nell'interconversione del fosfato Dhap Triosas e del gap catalizzato dall'enzima di triosa-fosfato isomerasi (TIM), un fatto che non richiede ulteriore contributo energetico e che è anche un processo reversibile anche un processo reversibile.
Diidrossicetone fosfato ↔ gliceraldeide 3-fosfato
- Fase di guadagno di energia
6- Il gliceraldeide 3-fosfato è usato "a valle" sulla via glicolitica come substrato per una reazione di ossidazione e un'altra fosforilazione, catalizzata dallo stesso enzima, gliceraldeide 3-fosfato deidrogenasi (GAPDH).
L'enzima catalizza l'ossidazione del carbonio C1 della molecola in un acido carbossilico e la fosforilazione di questo nella stessa posizione, producendo 1.3-bifosciede. Nel corso della reazione, 2 molecole NAD+ sono ridotte per molecola di glucosio e vengono utilizzate 2 molecole di fosfato inorganico.
Può servirti: trachea2Glyceraldeide 3-fosfato + 2NAD + + 2PI → 2 (1.3-bifosfoglycerato) + 2NADH + 2H
Negli organismi aerobici, ogni NADH prodotto in questo modo passa attraverso la catena del trasportatore di elettroni per fungere da substrato per la sintesi di 6 molecole ATP a causa della fosforilazione ossidativa.
7- Questa è la prima fase della sintesi di ATP nella glicolisi e implica l'azione della chinasi fosfoglycerato (PGK) su 1.3-bifosfoglicerato, trasferendo un gruppo fosforile (fosforilazione a livello di substrato) da questa molecola a una molecola ADP, producendo 2atp 2atp e 2 molecole di 3-fosfoglicerate (3pg) per ciascuna molecola di glucosio.
2 (1.3-bifosfoglycerato) + 2ADP → 2 (3-fosfoglicerato) + 2ATP
8- Il 3-fosfoglicerato funge da substrato per l'enzima fosfoglicerato mutasa (PGM), che lo rende 2-fosfoglicerato mediante spostamento del gruppo fosforile di carbonio 3 a carbonio 2 per mezzo di una reazione a due gradini che è reversibile e dipendente Ioni di magnesio (Mg+2).
2 (3-fosfoglicerato) → 2 (2-fosfoglicerato)
9- L'enzima in un deidrato 2-fosfoglicerato e produce fosfoenolpiruvato (PEP) per mezzo di una reazione che non merita l'aggiunta di energia aggiuntiva e che mira a produrre un composto ad alta energia, in grado di donare il suo gruppo fosforil.
2 (2-fosfoglicerato) → 2fosfoenolpiruvate
10- fosfoenolpiruvato è un substrato dell'enzima piruvato chinasi (PYK), che è responsabile del trasferimento del gruppo fosforil.
Nella reazione sono prodotte 2 molecole di piruvato 2ATP e 2 piruvato per ciascun glucosio e la presenza di potassio e magnesio in forma ionica è necessaria.
2fospo Elplivato + 2ADP → 2Pyruvate + 2ATP
Le prestazioni nette della glicolisi, in questo modo, sono costituite da 2ATP e 2NAD+ per ogni molecola di glucosio che entra nel percorso.
Se queste sono cellule con metabolismo aerobico, allora la degradazione totale di una molecola di glucosio produce tra 30 e 32 ATP attraverso il ciclo di Krebs e la catena di trasporto elettronico.
Prodotti di glicolisi
La reazione generale della glicolisi è la seguente:
Glucosio + 2NAD + + 2ADP + 2PI → 2Pyruvate + 2ATP + 2NADH + 2H+
Pertanto, se viene brevemente analizzato, potrebbe garantire che i principali prodotti della via glicolitica siano piruvato, ATP, NADH e H.
Tuttavia, la destinazione metabolica di ciascun intermediario di reazione dipende, in larga misura, dai bisogni cellulari, motivo per cui tutti gli intermediari possono essere considerati come prodotti di reazione, essendo in grado di mentarli come segue:
- Glucosio 6-fosfato
- Fruttosio 6-fosfato
- Fruttosio 1.6-bifosfato
- Diidrossicetone fosfato e gliceraldeide 3-fosfato
- 1.3-bifosfogliceto
- 3-fosfoglicerato e 2-fosfoglicerato
- Fosfoenolpiruvato e piruvato
Importanza
Sebbene la glicolisi, di per sé (potrebbe parlare di glicolisi anaerobica) produca solo circa il 5% dell'ATP che può essere estratto dal catabolismo aerobico del glucosio, questa via metabolica è fondamentale per diversi motivi:
- Funge da fonte di energia "veloce", specialmente in situazioni in cui un animale deve lasciare rapidamente uno stato di riposo, per le quali i processi di ossidazione aerobica non sarebbero abbastanza veloci.
- Le fibre muscolari "bianche" scheletriche nel corpo umano, ad esempio, sono fibre di contrazione rapida e dipendono dalla glicolisi anaerobica per funzionare.
- Quando, per qualche motivo, una cellula ha bisogno di glicolitico.
- Molte cellule dipendono dal glucosio come fonte di energia per via glicolitica, incluso il globuli rossi, Mancano organelli interni e cellule oculari (in particolare quelle della cornea) che non hanno una grande densità dei mitocondri.
Riferimenti
- Canback, b., Andersson, s. G. E., & Kurland, C. G. (2002). La filogenesi globale degli enzimi glicolitici. Atti della National Academy of Sciences, 99 (9), 6097-6102.
- Chaudhry R, Varacallo M. Biochimica, glicolisi. [Aggiornato 2019 AP 21]. In: Statpearls [Internet]. Treasure Island (FL): Statpearls Publishing; 2020 gen-. Disponibile da: https: // www.NCBI.Nlm.NIH.Gov/Libri/NBK482303/
- Fothergill-Gilmore, l. A., & Michels, P. A. (1993). Evoluzione della glicolisi. Progressi in biofisica e biologia molecolare, 59 (2), 105-235.
- Kim, J. W., & Dang, c. V. (2005). Ruoli sfaccettati di enzimi glicolitici. Tendenze nelle scienze biochimiche, 30 (3), 142-150.
- Kumari, a. (2017). Sweet Biochemistry: ricordare strutture, cicli e percorsi di mnemonics. Academic Press.
- Li, x. B., Gu, j. D., & Zhou, Q. H. (2015). Revisione della glicolisi aerobica e dei suoi enzimi chiave-nuovissimi per la terapia del cancro al polmone. Cancro toracico, 6 (1), 17-24.
- « Caratteristiche degli animali erbivori, tipi, esempi
- Caratteristiche del virus del mosaico del tabacco, struttura, replica »

