Forze di Londra
- 2450
- 271
- Dante Morelli
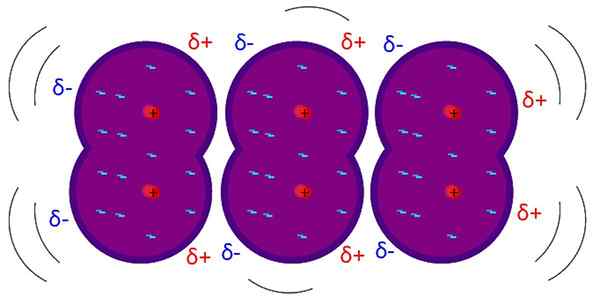
 Le forze di Londra sono interazioni deboli intermolecolari. Fonte: Riccardo Rovinetti, Wikimedia Commons
Le forze di Londra sono interazioni deboli intermolecolari. Fonte: Riccardo Rovinetti, Wikimedia Commons Quali sono le forze di Londra?
IL Forze di Londra, Le forze di dispersione di Londra o le interazioni di-dipolo indotte sono il tipo più debole di interazioni intermolecolari. Il suo nome è dovuto ai contributi del fisico teorico Fritz London (1900-1954) e dei suoi studi nel campo della fisica quantistica.
Le forze di Londra spiegano come le molecole interagiscono le cui strutture e atomi fanno la formazione di un dipolo permanente; cioè, si applica fondamentalmente alle molecole apolari o agli atomi isolati da gas nobili.
A differenza delle altre forze di van der Waals, ciò richiede distanze estremamente brevi.
Caratteristiche delle forze di Londra
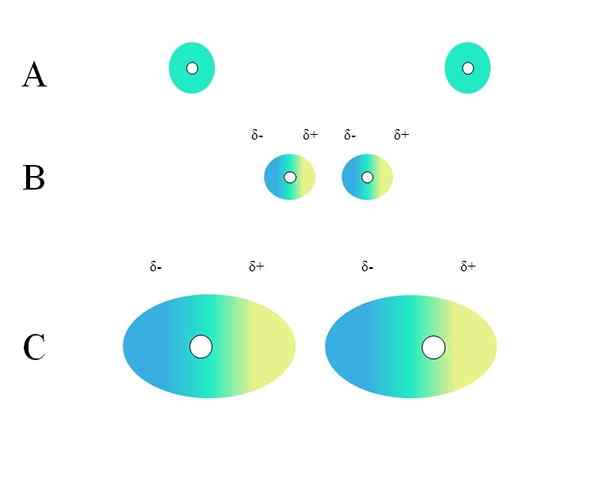 Distribuzione di accuse omogenee. Fonte: Gabriel Bolívar
Distribuzione di accuse omogenee. Fonte: Gabriel Bolívar Quali caratteristiche dovrebbe avere una molecola in modo che possa interagire attraverso le forze di Londra? La risposta è che chiunque potrebbe farlo, ma quando c'è un momento di dipolo permanente, le interazioni di tipo dipolo-dipolo predominano piuttosto che la dispersione, contribuendo molto poco alla natura fisica delle sostanze.
Nelle strutture in cui non esistono atomi molto elettronegativi o la cui distribuzione del carico elettrostatico è omogenea, non esiste un fine o una regione che può essere considerato ricco (Δ-) o scarso (Δ+) negli elettroni.
In questi casi, altri tipi di forze devono intervenire, o in altro modo questi composti potrebbero esistere solo in una fase gassosa, indipendentemente dalle condizioni di pressione o temperatura che operano su di essi.
Distribuzione del carico omogeneo
Due atomi isolati, come il neon o l'argon, hanno una distribuzione del carico omogeneo. Questo può essere visto in un'immagine superiore. I cerchi bianchi al centro rappresentano i nuclei, per gli atomi, o lo scheletro molecolare, per le molecole. Questa distribuzione del carico può essere considerata come una nuvola di elettroni verdi.
Perché i gas nobili incontrano questa omogeneità? Poiché hanno il loro strato elettronico completamente pieno, quindi i loro elettroni teoricamente devono sentire ugualmente l'attrazione del carico del nucleo in tutti gli orbitali.
D'altra parte, per altri gas come l'ossigeno atomico (O), il suo strato è incompleto (che si osserva nella sua configurazione elettronica) e lo costringe a formare la molecola diatomica o2 Per compensare questa carenza.
I cerchi verdi di A possono anche essere molecole, piccole o grandi. La sua orbita elettroni nutre intorno a tutti gli atomi che lo compongono, specialmente per i più elettronegativi. Intorno a questi atomi la nuvola si concentrerà e sarà più negativa, mentre altri atomi avranno una carenza elettronica.
Può servirti: legame covalente non polareTuttavia, questa nuvola non è statica ma dinamica, quindi ad un certo punto verranno formate brevi regioni Δ- e Δ+e si verificherà un fenomeno chiamato Polarizzazione.
Polarizzabilità
Nella nuvola verde indica una distribuzione del carico negativo omogeneo. Tuttavia, la forza di attrazione positiva esercitata dal nucleo può variare sugli elettroni. Ciò provoca una deformazione delle nuvole creando così Δ-regioni, blu e Δ+, giallo.
Questo improvviso momento di dipolo nell'atomo o nella molecola può distorcere una nuvola elettronica adiacente; In altre parole, induce un dipolo improvviso sul suo vicino (b, immagine superiore).
Questo perché la regione Δ disturba la nuvola vicina, i suoi elettroni sentono una repulsione elettrostatica e sono orientati nel polo opposto, apparendo Δ+.
Nota come i poli positivi sono allineati con gli aspetti negativi, proprio come le molecole con momenti di dipolo permanente. Più voluminosa è la nuvola elettronica, più difficoltà il nucleo lo manterrà omogeneo nello spazio; E inoltre, sarà la sua deformazione, come si può vedere in C.
Pertanto, è improbabile che piccoli atomi e molecole siano polarizzati da qualsiasi particella di ciò che li circonda. Un esempio per questa situazione è illustrato dalla piccola molecola di idrogeno, h2.
Condensare, o ancora di più, cristallizza, ha bisogno di pressioni esorbitanti per costringere le sue molecole a interagire fisicamente.
È inversamente proporzionale alla distanza
Sebbene si formino dipoli istantanei che inducono altri intorno a loro, non sono abbastanza per tenere insieme atomi o molecole.
In B c'è una distanza D che separa le due nuvole e i loro due nuclei. In modo che entrambi i dipoli possano rimanere per un po 'di tempo, questa distanza D Deve essere molto piccolo.
Questa condizione deve essere soddisfatta, una caratteristica essenziale delle forze di Londra (ricorda la chiusura del velcro), in modo che venga fornito un effetto famigerato sulle proprietà fisiche della questione.
Una volta D Sii piccolo, il nucleo della sinistra in b inizierà ad attirare la regione blu Δ- dell'atomo o della molecola vicina. Ciò deformerà ulteriormente la nuvola, come si può vedere in C (il nucleo non è più al centro ma a destra).
Può servirti: alcheniQuindi, c'è un punto in cui entrambe le nuvole toccano e "rimbalzano", ma per una lentezza abbastanza da averle insieme a un tempo.
Pertanto, le forze di Londra sono inversamente proporzionali alla distanza D. In effetti, il fattore è uguale a D7, Quindi una variazione minima della distanza tra atomi o molecole indebolirà o rafforzerà la dispersione di Londra.
È direttamente proporzionale alla massa molecolare
Come aumentare le dimensioni delle nuvole in modo che siano più facilmente polarizzate? Aggiungere elettroni e per questo il nucleo deve avere più protoni e neutroni, aumentando così la massa atomica; o aggiungere atomi allo scheletro della molecola, che a sua volta aumenterebbe la sua massa molecolare.
In questo modo, i nuclei o lo scheletro molecolare avrebbero meno probabilità di mantenere la nuvola elettronica per tutto il tempo. Pertanto, più grandi i cerchi verdi considerati in A, B e C, più potrarizzabili saranno e maggiore saranno anche le loro interazioni dalle forze di Londra.
Questo effetto è chiaramente osservato tra B e C e potrebbe essere ancora di più se i cerchi avessero un diametro maggiore. Questo ragionamento è la chiave per spiegare le proprietà fisiche di molti composti a seconda delle loro masse molecolari.
Esempi di forze di Londra
 Esempio naturale delle forze di Londra: le gambe dei Gecos
Esempio naturale delle forze di Londra: le gambe dei Gecos In natura
Nella vita quotidiana ci sono innumerevoli esempi delle forze di dispersione di Londra senza la necessità di avventurarsi, in primo luogo, il mondo microscopico.
Uno degli esempi più comuni e sorprendenti si trova nelle gambe dei rettili noti come Gecos (immagine superiore) e in molti insetti (anche in Spiderman).
Nelle loro gambe hanno alcuni cuscinetti di cui spiccano migliaia di piccoli filamenti. Nell'immagine puoi vedere un GECO in posa sul pendio di una roccia. Per raggiungere questo obiettivo, utilizza le forze intermolecolari tra la roccia e i filamenti delle gambe.
Ognuno di questi filamenti interagisce debolmente con la superficie attraverso la quale il piccolo rettile. I Gecos sono anche in grado di scalare superfici lisce e perfette come quelle dei cristalli.
Può servirti: nitrito di potassio (KNO2): struttura, proprietà e usiChiude
Gli alcani sono idrocarburi saturi che interagiscono anche dalle forze di Londra. Le sue strutture molecolari sono semplicemente costituite da carboni e idrogeni uniti da semplici legami. Poiché la differenza nelle elettronegatività tra C e H è molto piccola, sono composti apolari.
Quindi, metano, Cho4, L'idrocarburo più piccolo di tutti, bolle a -161.7 ° c. Poiché C e H vengono aggiunti allo scheletro, altri alcani sono ottenuti con masse molecolari più alte.
In questo modo, sorge l'etano (-88.6 ° c), butano (-0.5 ° c) e l'ottano (125.7 ° c). Nota come aumentano i loro punti di ebollizione man mano che gli alcani diventano più pesanti.
Questo perché le loro nuvole elettroniche sono più polarizzabili e le loro strutture hanno un'area superficiale maggiore, che aumentano il contatto tra le loro molecole.
L'ottano, sebbene sia un composto apolare, ha un punto di ebollizione maggiore di quello dell'acqua.
Alogeni e gas
Le forze di Londra sono presenti anche in molte sostanze gassose. Ad esempio, N molecole2, H2, Co2, F2, Cl2 E tutti i gas nobili interagiscono attraverso queste forze, poiché hanno una distribuzione elettrostatica omogenea, che può soffrire di istantanee e dare origine a polarizzazioni.
I gas nobili sono lui (elio), neon (neon), AR (argon), KR (Kripton), xe (xenon) e rn (radon). Da sinistra a destra i loro punti di ebollizione aumentano con l'aumento delle masse atomiche: -269, -246, -186, -152, -108 e -62 ºC.
Gli alogeni interagiscono anche attraverso queste forze. Il fluoro è un gas a temperatura ambiente, proprio come il cloro. Il bromo, con maggiore massa atomica, è in condizioni normali come un liquido rossastro e lo iodio, per finire, forma un solido viola che sublima rapidamente perché è più pesante degli altri alogeni.
Riferimenti
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). Cengage Learning, P 452-455.
- Angeles Méndez. (22 maggio 2012). Forze di dispersione (da Londra). Recuperato da: chimica.Laguia2000.com
- Forze di dispersione di Londra. Recuperato da: Chem.Purdue.Edu
- Helmestine, Anne Marie, PH.D. (22 giugno 2018). 3 tipi di forze intermolecolari. Recuperato da: Thoughtco.com
- Ryan Ilagan e Gary L Bertrand. Interazioni di dispersione di Londra. Tratto da: Chem.Librettexts.org
- Chempages Noriales. Forze di Londra. Recuperato da: Chem.Wisc.Edu
- Kamereon. (22 maggio 2013). Salamanqueas: il Geco e le forze di Van der Waals. Recuperato da: Almabiologica.com

