Formula minima come rimuovere la formula minima, esempi ed esercizi
- 1265
- 357
- Rufo Longo
IL Formula minima o empirica È un'espressione della proporzione in cui sono presenti gli atomi dei diversi elementi che formano un composto chimico. La formula minima è quindi la rappresentazione più semplice di un composto chimico. A questo è dovuto al "minimo".
La formula minima non esprime i numeri atomi dei diversi elementi che formano un composto chimico; ma la proporzione in cui questi atomi sono combinati per generare il composto chimico.
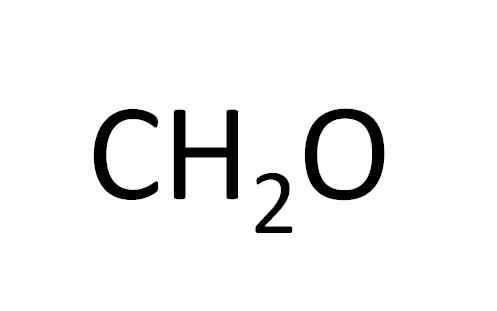
 Questa formula minima rivela a malapena che il composto ha le stesse quantità di atomi di carbonio e ossigeno e atomi a doppio idrogeno. Fonte: Gabriel Bolívar.
Questa formula minima rivela a malapena che il composto ha le stesse quantità di atomi di carbonio e ossigeno e atomi a doppio idrogeno. Fonte: Gabriel Bolívar. La formula minima è anche chiamata formula empirica, poiché è ottenuta dalla sperimentazione; cioè, è legato all'esperienza. L'osservazione sperimentale ha permesso di concludere che due atomi di idrogeno sono combinati con un atomo di idrogeno per formare acqua (H2O).
In molti casi, la formula minima coincide con la formula molecolare. Nel molecolare viene visualizzato il numero reale dei diversi elementi che formano un composto chimico; Questo è il caso, ad esempio, acido solforico (h2SW4).
Ma in altri casi, non vi è alcuna coincidenza della formula minima e della formula molecolare; Questo è il caso del benzene: la formula minima è CH, mentre la sua formula molecolare è C6H6.
[TOC]
Come ottenere la formula minima?
Primo passo
Trova i grammi di ciascun elemento presenti nel composto. Come di solito espresso in percentuale della massa del composto, è necessario effettuare un semplice calcolo per la trasformazione delle percentuali di massa di massa degli elementi.
Secondo passo
Si ottengono il numero relativo degli atomi dei diversi elementi che formano il composto chimico. Per fare ciò, la massa di ogni elemento è divisa, espressa in grammi, tra la sua massa atomica.
Alcuni autori preferiscono chiamare il numero relativo di atomi, come il numero di moli di atomi degli elementi che fanno parte del composto chimico.
Può servirti: bulanal: struttura, proprietà, usi e rischiTerzo passo
Ottenere la proporzione minima, espressa in numero intero, di ciascuno degli atomi presenti nel composto chimico.
Per trovare questi valori, il numero relativo di ciascun atomo presente nel composto tra il valore numerico relativo che un atomo nel composto chimico è diviso.
Nel caso in cui il valore della proporzione minima di un atomo non sia un numero intero senza decimali, tutti i valori della proporzione minima di un numero devono essere moltiplicati; In questo modo, che consente a tutti i valori della proporzione minima di essere numeri interi.
Ad esempio, se il valore della proporzione minima di un atomo del composto chimico è 2.5, deve essere moltiplicato Tutto i valori della proporzione minima di ciascuno degli atomi presenti per 2. Pertanto, tutti i valori della proporzione minima saranno solo numeri interi.
Quarto passo
Scrivi la formula minima composta. I valori della proporzione minima per gli atomi dei diversi elementi saranno posizionati come abbonamenti dei simboli chimici degli elementi per scrivere la formula minima.
Esempi di formula minimi
Acqua e anidride carbonica
La maggior parte dei composti chimici ha formule che sono, allo stesso tempo, formule minime e molecolari. Pertanto, la formula dell'acqua (h2O) è una formula minima; Ma è anche una formula molecolare. Lo stesso vale per la formula di anidride carbonica (CO2).
Ossidi di base e acidi
Gli ossidi e gli acidi di base sono composti chimici che hanno formule chimiche, a meno che non per eccezioni che siano sia le formule minime e molecolari. La stessa situazione si verifica con idrossidi e acidi, ad eccezione di alcuni acidi carbossilici.
Può servirti: acetonitrile (C2H3N)Acido acetico
Gli acidi carbossilici che hanno un numero di coppie di atomi di carbonio nella loro composizione, sono separatamente, una formula minima e una formula molecolare. L'acido acetico, ad esempio, ha una formula molecolare (c2H4O2); Ma presenta anche una formula minima (Cho2O).
Acido butirrico
Anche l'acido butirrico ha una formula molecolare (c4H8O2) e una formula minima (c2H4O).
Glicole etilenico
Altri composti organici hanno i due tipi di formule chimiche; Questo è il caso del glicole etilenico, che ha una formula molecolare (c2H6O2) e una formula minima (Cho3O).
Benzene
Il benzene, un composto aromatico, ha una formula molecolare (C6H6) e una formula minima (CH).
Glucosio
Il glucosio ha una formula molecolare (c6H12O6) e una formula minima (Cho2O).
Esercizi risolti
- Esercizio 1
Il glicole etilenico è un composto usato come antigelo, ha un peso molecolare di 62,1 g/mol e una composizione percentuale di massa successiva:
C: 38 %,
H: 9,7 %
O: 51,16 %.
Primo passo
Esprimere le percentuali di massa degli elementi nelle loro masse in grammi. Per fare ciò, il peso molecolare dell'etilenglicolo viene preso come riferimento. Se questo è 62,1 grammi per mol, il 38% dello stesso è costituito da carbonio. E così via con gli altri elementi:
Massa di carbonio = 62,1 g · (38/100)
= 23,6 g
Massa idrogeno = 62,1 g · (9,7/100)
= 6.024 g
Massa di ossigeno = 62,1 g · (51,16/100)
= 31,77 g
Secondo passo
Calcola il numero relativo di ciascun atomo presente (NRA) o il numero di moli di ciascun atomo. Per fare ciò, la massa di ogni elemento chimico è divisa per la sua massa atomica.
NRA (c) = 23,6 g / 12 g
= 1.97
Può essere arrotondato a 2.
NRA (H) = 6.024 g / 1 g
= 6.024
Può essere arrotondato a 6.
NRA (O) = 31,77 g /16 g
= 1.985
Può essere arrotondato a 2.
Terzo passo
Calcola la proporzione minima dell'intero numero degli elementi del composto (PMNE). Per fare ciò, ciascuno dei valori dei numeri relativi atomici (NRA) è diviso per il valore più basso di questo. In questo caso, 2.
Può servirti: acido propanoPMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Quarto passo
Scrivi la formula minima di glicole etilenico:
Cap3O
Come si può vedere, i valori ottenuti nel passaggio 3 sono gli abbonamenti degli elementi composti.
- Esercizio 2
L'acido acetico ha un peso molecolare di 60 g/mol e una composizione percentuale di massa seguente:
C: 40 %
H: 6,67 %
O: 53,33 %
Ottieni la formula minima del composto.
Primo passo
Trasformare le percentuali di massa degli elementi nelle loro masse espresse nei grammi:
Massa di carbonio = 60 g · (40/100)
= 24 g
Massa idrogeno = 60 g · (6,67/100)
= 4 g
Massa di ossigeno = 60 g · (53,33/100)
= 32 g
Secondo passo
Calcola il numero relativo degli atomi (NRA) del composto. Per fare ciò, le masse degli elementi sono divise tra le loro masse atomiche:
NRA (c) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Terzo passo
Ottieni la proporzione minima del numero intero degli elementi del composto (PMNE). Per fare ciò, i valori NRA degli elementi sono divisi tra il valore inferiore di NRA che presentano un elemento:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Quarto passo
Scrivi la formula minima di acido acetico:
Cap2O
Gli abbonamenti del composto sono i valori ottenuti da PMNE.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Helmestine, Anne Marie, PH.D. (27 agosto 2019). Formula empirica: definizione ed esempio. Recuperato da: Thoughtco.com
- Wikipedia. (2020). Formula empirica. Recuperato da: in.Wikipedia.org
- Chimica librettexts. (3 luglio 2019). Formule di calcolo empirico per i composti. Recuperato da: Chem.Librettexts.org
- Nicola McDougal. (2020). Formula empirica: definizione, passi ed esempio. Studio. Recuperato da: studio.com
- « Caratteristiche ed esempi di reazione irreversibili
- Formula molecolare come tirarlo fuori, esempi ed esercizi »

