Struttura del sodio fosfato, proprietà, sintesi, usi

- 1744
- 166
- Brigitta Ferrari
Lui Fosfato di sodio È un sale inorganico la cui formula chimica è na3Po4. Riceve anche nomi di fosfato trisodiosi (TSP per il suo acronimo in inglese: Fosfato di sodio) o fosfato di sodio tribasico, perché manca completamente della capacità di donare ioni idrogeno H+.
Quando ci alludi in modo plurale, fosfati di sodio, si parla dell'intero compendio di sali, idratato o no, originato da interazioni elettrostatiche tra NA+ e il po43-. Alcuni di questi sali sono persino costituiti da pirofosfati di sodio o polimeri inorganici che possiedono il PO43- come monomero.
 Vetro orologio con cristalli di fosfato di sodio. Fonte: Ondřej Mangl [dominio pubblico]
Vetro orologio con cristalli di fosfato di sodio. Fonte: Ondřej Mangl [dominio pubblico] Ecco perché, a meno che non venga effettuata una specifica, si riferirà sempre a NA3Po4, E non a nah2PO4, NA2HPO4, N / a4P2O7 Non nessun altro sale.
L'immagine superiore mostra l'aspetto del fosfato di sodio, che sembra cristalli bianchi simili a quelli di sale o tavolo comuni, o acquistati come polvere bianca amorfo che guarda. Poi un3Po4 è in grado di formare diversi idrati, essendo il NA3Po4· 12h2O quello che è più commercializzato.
Trova l'uso principalmente nell'industria alimentare, in detergenti, integratori sportivi e funge da lassativo iperosmotico.
[TOC]
Struttura chimica
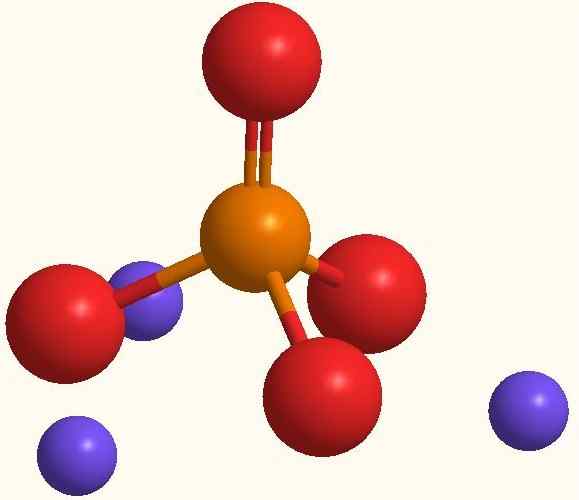 Ioni principali di sodio fosfato. Fonte: Smolamj via Wikipedia.
Ioni principali di sodio fosfato. Fonte: Smolamj via Wikipedia. La stessa formula NA3Po4 indica che per ogni anione po43- Ci sono tre cationi+. Questi ioni possono essere osservati nell'immagine superiore. Nota che il PO43- Ha una geometria tetraedrica, con i suoi atomi di ossigeno che trasportano un carico negativo risonante, che attira il NA+ dell'ambiente.
Inoltre, la formula NA3Po4 Sottolinea che è sale anidro, quindi non ci sono molecole d'acqua incluse nei loro cristalli. Attrazioni elettrostatiche tra Na+ e il po43- Finiscono per definire un cristallo bianco trigonale. Il suo legame ionico è tale che il Na3Po4 Ha un punto di fusione di 1583 ºC, considerevolmente più alto di quello di diversi sali.
Può servirti: reazione di cannizzaro: caratteristiche, meccanismi, esempiEntrambi il na+ Come Po43- Sono ioni che possono essere idratati in alto grado, senza influire negativamente sulla stabilità dei cristalli.
È per questo motivo che anche gli idrati possono cristallizzare; Tuttavia, i suoi punti di fusione sono inferiori a quelli di sale anidro, poiché i ponti idrogeno intermolecolari dell'acqua separano gli ioni e indeboliscono le loro interazioni. Nel na3Po4· 12h2O, ad esempio, il suo punto di fusione è 73,4 ºC, molto meno di quello di NA3Po4.
Proprietà
Aspetto fisico
Può verificarsi come cristalli bianchi definiti o come polvere o granuli dello stesso colore. Tutte le magnitudini fisiche espresse al di sotto allude solo al sale ingenuo3Po4.
Punto di fusione
1583 ºC
Punto di ebollizione
100 ºC
Solubilità dell'acqua
14,5 g/100 ml a 25 ° C, quindi è considerato un fosfato di acqua abbastanza solubile. Tuttavia, è insolubile in solventi organici come etanolo e disolfuro di carbonio.
Densità
2.536 g/cm3 a 17,5 ºC.
Stabilità
È un solido igroscopico. Pertanto, deve essere conservato in modo tale da non poter essere esposto all'umidità.
ph
È un sale fortemente alcalino. Ad esempio, una soluzione acquosa dell'IT 0,1% ha già pH 11,5. Questa proprietà serve a essere utilizzata come additivo nei detergenti.
Sintesi
Come vengono prodotti o sintetizzati il fosfato di sodio? Per fare questo, si basa sull'acido fosforico, h3Po4, o dal sale di sale di sale sodio, nah2Po4.
Nella stragrande maggioranza della sintesi, è preferita h3Po4. Pertanto, l'H viene reagita3Po4 Con una base che neutralizza i suoi tre gruppi OH, tenendo conto del fatto che questo acido può anche essere scritto come PO (OH)3.
Può servirti: saldo del soggetto: cosa è, equazione generale, tipiLa base per preferenza è l'idrossido di sodio, NaOH (in Germania), ma è anche praticabile (e più economico) per usare il carbonato di sodio o la cenere di Sosa, Na2Co3 (negli Stati Uniti). Le equazioni per entrambe le reazioni di neutralizzazione sono:
N / a2Co3 + H3Po4 → Na2HPO4 + Co2 + H2O
N / a2HPO4 + NaOH → Na3Po4 + H2O
Si noti che quando si utilizza il NA2Co3 NA non si ottiene3Po4 ma il na2HPO4, che avrà bisogno di una successiva neutralizzazione. Essere la reazione acquosa significa, cristallizza il NA3Po4· 12h2Oppure, quindi deve essere calcolato per eliminare il suo contenuto d'acqua e causare sale anidro.
Poi un3Po4· 12h2O È caratterizzato dalla "fusione" dei loro cristalli in una massa compatta difficile. Più piccole le dimensioni dei loro cristalli, più velocemente la sua calcinazione sarà.
Applicazioni
Cibo
 Il fosfato di sodio viene utilizzato come agente effervescente per espandere i ruoli o le torte di cannella. Fonte: Pixabay.
Il fosfato di sodio viene utilizzato come agente effervescente per espandere i ruoli o le torte di cannella. Fonte: Pixabay. Negli usi del fosfato di sodio è inevitabile mescolare la Na3Po4 o na3Po4· 12h2Oppure, perché quest'ultimo è l'idrato che è più commercializzato. Ad esempio, uno dei due fornisce ioni innocui (in teoria) al cibo a cui vengono aggiunti, arricchendoli dei fosfati e allo stesso tempo aumentano la loro salinità.
Nello salar delle carni, la na3Po4· 12h2O è incluso per mantenerli freschi più a lungo durante il loro deposito. Viene anche aggiunto come agente emulsionante in modo che la miscela di acqua petrolifera non sia "tagliata", ma rimane unita; E come regolatore di pH, perché aiuta a ridurre l'acidità del cibo (compresi i cereali).
Può servirti: silicato di calcio: proprietà, struttura, ottiene, usiInoltre, viene utilizzato per addensare alcune salse di pomodoro e per la cottura di torte o pane (immagine superiore). Quest'ultimo è perché il NA3Po4· 12h2O tende a rilasciare il vapore acqueo, che aumenta le dimensioni dei pori della massa della farina e il volume dello stesso.
Detergenti
Il fosfato di sodio è abbastanza semplice da saponificare alcuni grassi o oli con cui hai contatto. La sua alcalinità viene quindi utilizzata per migliorare l'azione dei detergenti, purché la superficie alla miseria non sia in metallo, in quanto possono deteriorarla.
Tuttavia, la produzione di detergenti arricchiti con fosfati è stata ridotta perché producono l'eutrofizzazione di laghi e fiumi e, con essa, la proliferazione di alghe che copre le loro superfici.
È stato anche usato per l'elaborazione di un disinfettante: NA3Po4· 1/4Naocl · 11h2Oppure, che viene preparato usando l'ipoclorito di sodio, Naocl, anziché NaOH o Na2Co3 Per neutralizzare h3Po4.
Medicinale
Poi un3Po4 Induce la defecazione agendo come un lassativo iperosmotico, necessario per pulire il colon prima che il paziente subisca una colonscopia. D'altra parte, è stato anche utilizzato (aggiunto) in integratori energetici.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Fosfato di sodio. Database PubChem. CID = 24243. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Fosfato di sodio. Recuperato da: in.Wikipedia.org
- Curran m.P. & Plosker g.L. (2004). Soluzione orale del fosfato di sodio: una revisione dei suoi usi per il detergente del colon -retto. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22 dicembre 2017). Fosfato di sodio. Recuperato da: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Processo per la produzione di fosfato di trisodium. Estratto da: FreePatentssonline.com
- Maryann Marks. (2018). Perché Trisodium Fosfato (TSP) è aggiunto al nostro cibo? Recuperato da: theingredientguru.com

