Fase dispersa
- 2578
- 44
- Lidia Valentini
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Qual è la fase dispersa?
IL fase dispersa È quello che è in una proporzione minore in una dispersione ed è composto da aggregati di particelle molto piccoli. Nel frattempo, la fase più abbondante e continua in cui le particelle si trovano è chiamata fase di dispersione. Un esempio è l'acqua con zucchero, in cui la fase dispersa sarebbe lo zucchero e la dispersione dell'acqua.
Le dispersioni sono classificate in base alle dimensioni delle particelle che formano la fase dispersa, essendo in grado di distinguere tre tipi di dispersioni: dispersioni scortesi, soluzioni colloidali e soluzioni vere.
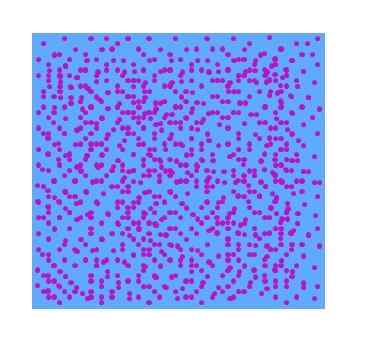
Nell'immagine superiore si può vedere un'ipotetica fase dispersa di particelle viola in acqua. Di conseguenza, un bicchiere pieno di questa dispersione non mostrerà trasparenza alla luce visibile; Cioè, sembrerà uno yogurt liquido viola. Il tipo di dispersioni varia a seconda delle dimensioni di tali particelle.
Quando sono "fantastici" (10-7 m) si parla di dispersioni scortese e si può sedimenti dall'azione della gravità; soluzioni colloidali, se le loro dimensioni vanno tra 10-9 M e 10-6 M, che li rende visibili solo con ultramicroscopio o microscopio elettronico; e vere soluzioni, se le loro dimensioni sono inferiori a 10-9 M, essere in grado di incrociare le membrane.
Le vere soluzioni sono, quindi, tutte quelle che sono popolarmente conosciute, come l'aceto o l'acqua zuccherata.
Caratteristiche della fase dispersa
Le soluzioni costituiscono un caso particolare di dispersioni, essendo di grande interesse per la conoscenza della fisioquimica degli esseri viventi. La maggior parte delle sostanze biologiche, sia intracellulari che extracellulari, si trovano sotto forma di dispersioni di chiamate.
Movimento browniano e effetto Tyndall
Le particelle della fase dispersa delle soluzioni colloidali hanno una dimensione ridotta che ostacola la loro sedimentazione. Inoltre, le particelle si muovono costantemente in movimento casuale, si scontrano tra loro, il che rende anche difficile la sedimentazione. Questo tipo di movimento è noto come browniano.
Può servirti: vetro violaA causa delle dimensioni relativamente grandi delle particelle di fase disperse, le soluzioni colloidali hanno un aspetto oscuro o addirittura opaco. Questo perché la luce è dispersa quando il colloide si incrocia, un fenomeno noto come effetto tyndall.
Eterogeneità
I sistemi colloidali sono sistemi non omogenei, poiché la fase dispersa è costituita da particelle con un diametro tra 10-9 M e 10-6 M. Mentre le particelle di soluzione sono di dimensioni più piccole, di solito meno di 10-9 M.
Le particelle della fase dispersa delle soluzioni colloidali possono incrociare la carta e il filtro dell'argilla. Ma non possono attraversare membrane di dialisi come cellophane, endotelio capillare e colodione.
In alcuni casi, le particelle che formano la fase dispersa sono proteine. Quando sono in fase acquosa, le proteine si piegano, lasciando la parte idrofila all'esterno per una maggiore interazione con l'acqua, attraverso le forze ion-dipolo o con la formazione di ponti idrogeno.
Le proteine formano un sistema reticolare all'interno delle cellule, essendo in grado di prendere una parte del disperso. Inoltre, la superficie delle proteine serve a unirsi a piccole molecole che conferiscono una carica elettrica superficiale, che limita l'interazione tra molecole proteiche, impedendo loro di costituire coaguli che causano sedimentazione.
Stabilità
I colloidi sono classificati in base all'attrazione tra la fase dispersa e la fase di dispersione. Se la fase di dispersione è liquida, i sistemi colloidali sono classificati come soli. Questi sono suddivisi in delifilos e liofobi.
Può servirti: clorato di potassio (KCLO3)I colloidi liofili possono formare soluzioni vere e sono termodinamicamente stabili. D'altra parte, i colloidi di liofobi possono formare due fasi, poiché sono instabili, sebbene stabili dal punto di vista cinetico. Ciò consente loro di rimanere in uno stato disperso per molto tempo.
Esempi di fase dispersi
Sia la fase di dispersione che la fase dispersa possono verificarsi nei tre stati fisici della materia, cioè solido, liquido o gassoso.
Normalmente, la fase continua o dispersa è in uno stato liquido, ma si possono trovare colloidi i cui componenti si trovano in altri stati di aggregazione della materia.
Le possibilità di combinazione della fase di dispersione e la fase dispersa in questi stati fisici sono nove.
Ognuno verrà spiegato con alcuni rispettivi esempi.
- Soluzioni solide: Quando la fase di dispersione è solida, può essere combinata con una fase dispersa allo stato solido, formando le soluzioni solide così chiamate.
Questi sono esempi di queste interazioni: molte leghe in acciaio con altri metalli, alcune gemme colorate, gomma rinforzata, porcellana e materie plastiche pigmentate.
- Emulsioni solide: La fase di dispersione a stato solido può essere combinata con una fase dispersa liquida, formando le emulsioni solide così chiamate. Sono esempi di queste interazioni: formaggio, burro e gelatina.
- Schiume solide: La fase di dispersione come solido può essere combinata con una fase dispersa in uno stato gassoso, che costituisce le schiume solide così chiamate. Esempi di queste interazioni sono spugne, gomma, pietra pompe e schiuma di gomma.
- Suole e gel: La fase di dispersione nello stato liquido è combinata con la fase dispersa allo stato solido, formando i soli e i gel. Esempi di queste interazioni sono latte di magnesia, dipinti, fango e pudin.
Può servirti: soluzioni per ammortizzatori- Emulsioni: La fase di dispersione nello stato liquido è combinata con la fase dispersa anche in uno stato liquido, producendo le emulsioni così chiamate. Esempi di queste interazioni sono latte, crema per il viso, condimenti per insalata e maionese.
- Schiume: La fase di dispersione nello stato liquido è combinata con la fase dispersa in uno stato gassoso, formando le schiume. Esempi di queste interazioni sono la crema da barba, la panna montata e la schiuma di birra.
- Aerosol solidi: La fase di dispersione in uno stato gassoso è combinata con la fase dispersa allo stato solido, causando gli aerosol solidi così chiamati. Esempi di queste interazioni sono fumo, virus, materiali corpuscolari nell'aria, i materiali emessi dai tubi di scarico delle auto.
- Aerosol liquidi: La fase di dispersione in uno stato gassoso può essere combinata con la fase dispersa nello stato liquido, costituendo gli spray liquidi così chiamati. Esempi di queste interazioni sono nebbia, nebbia e rugiada.
- Vere soluzioni: La fase di dispersione in uno stato gassoso può essere combinata con la fase gassosa nello stato gassoso, formando le miscele gassose che sono vere soluzioni e non sistemi colloidali. Esempi di queste interazioni sono l'aria e il gas di illuminazione.
Riferimenti
- Whitten, Davis, Peck e Stanley. Chimica (8.ª ed.). Apprendimento del Cengage.
- Toppr (s.F.). Classificazione dei colloidi. Recuperato da: toppr.com
- Jiménez Vargas, J e Macarulla. J. M. (1984). Fisiologico fisico, sesta edizione. Editoriale interamericano.
- Madhusha. Differenza tra fase disperse e dispersione Medum. Recuperato da: pediaa.com

