Legame covalente
- 4681
- 203
- Enzo De Angelis
Cos'è un collegamento covalente?
Il legame covalente è una forte interazione che consente a due o più atomi di unirsi per formare molecole. Questo è uno dei tipi di legami chimici in cui partecipa un paio di elettroni che provengono dagli orbitali più esterni degli atomi che sono collegati.
In teoria, ogni atomo contribuisce con uno dei due elettroni quando si collegano in modo covalente, in modo che vincano la stabilità. La coppia di elettroni, che diventa una sorta di "gancio elettronico" tra i due nuclei atomici, è condivisa equamente tra due atomi identici, ma ciò non accade quando i due atomi sono di due diversi elementi.
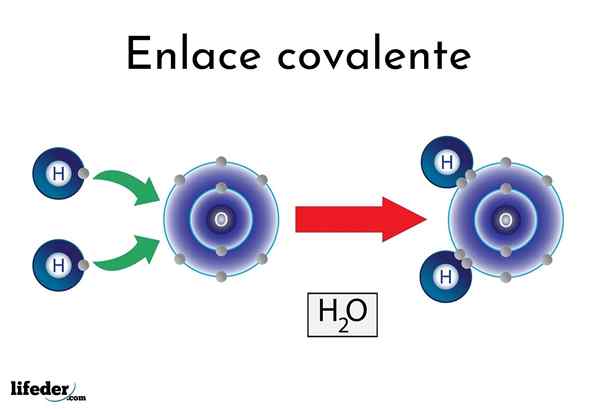
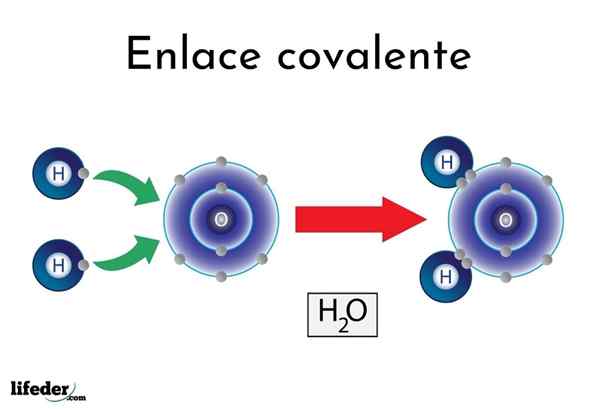 Legame covalente d'acqua
Legame covalente d'acqua Ci sono atomi o elementi che hanno una naturale tendenza a produrre elettroni, mentre altri preferiscono vincerli.
Ad esempio, la famosa molecola d'acqua, H2Oppure ha due collegamenti covalenti: H-O-H. Gli idrogeni e l'ossigeno condividono le due coppie di elettroni, ma queste orbite più vicine all'atomo di ossigeno rispetto all'idrogeno. Questo fenomeno è dovuto alla polarità e all'elettronegatività.
Caratteristiche dei legami covalenti
I legami covalenti presentano le seguenti caratteristiche:
-Coinvolgono un paio di elettroni per ogni legame covalente.
-Le sue lunghezze sono generalmente espresse in unità PM (picometri) o Armstrong (Å).
-Sono difficili da rompere, il che significa che sono molto forti.
-Quando si rompono, si verificano cambiamenti chimici o trasformazioni, poiché la molecola sta perdendo gli atomi. In questo processo l'energia viene assorbita.
-Quando si formano, nasce una nuova molecola. In questo processo viene rilasciata l'energia.
Può servirti: reazioni chimiche: caratteristiche, parti, tipi, esempi-Le sue lunghezze variano in base all'avidità che uno degli atomi collegati ha verso la coppia di elettroni; Cioè, più lo attira, il collegamento covalente è allungato.
-I legami covalenti più semplici esistono solo tra due atomi contemporaneamente e sono rappresentati con uno script o una linea (-).
Esistono altre caratteristiche che si applicano per collegamenti covalenti più complessi, che tuttavia sono anche conformi a ciò che viene commentato sopra.
Tipi di collegamenti covalenti
I legami covalenti possono essere classificati, in linea di principio, in due modi: in base al numero di elettroni condivisi e secondo la conseguente polarità quando si forma la molecola. Entrambi saranno descritti superficialmente di seguito.
Secondo il numero di elettroni condivisi
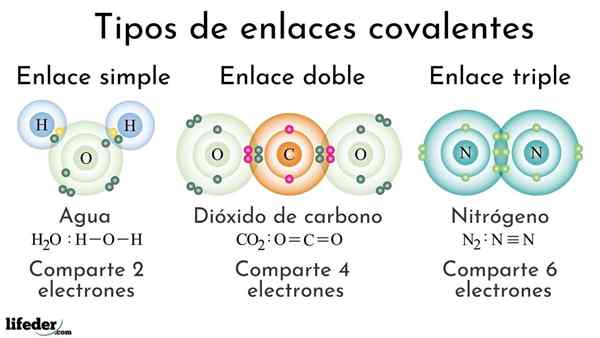 Tipi di legami covalenti in base al numero di elettroni condivisi
Tipi di legami covalenti in base al numero di elettroni condivisi I legami covalenti in base al numero di elettroni condivisi possono essere classificati come semplici, doppi o tripli. Nell'immagine superiore questi rispettivi collegamenti per tre molecole che verranno discusse di seguito sono mostrati.
-
Semplice
Il semplice legame covalente è quello in cui ci sono solo un paio di elettroni, cioè due elettroni. Un esempio di questo collegamento che vediamo nella molecola d'acqua, h2O. Si noti che di tutti i legami covalenti, il semplice, i-i, è il più lungo di tutti. Questo è quasi sempre.
-
Doppio
Nel doppio legame covalente abbiamo, come suggerisce il nome, due coppie di elettroni, il che significa che ci sono quattro elettroni che rafforzano il "gancio elettronico" tra i due atomi collegati.
Cioè, un doppio legame (=) è più forte di uno semplice (-). Tuttavia, è più reattivo, che sebbene possa sembrare contraddittorio, è facile da spiegare considerando la sovrapposizione degli orbitali atomici.
Può servirti: polarità (chimica): cosa è, definizione, esempiUn esempio di questo collegamento è visto nella molecola di anidride carbonica, CO2. I due atomi di ossigeno rimangono fortemente uniti al carbonio grazie a questo legame, o = c = o, che, per essere più forti, più vicini agli atomi; E a sua volta questo porta il collegamento ridotto.
-
Triplicare
Il triplo collegamento è il più forte e più breve dei legami covalenti (comune). Si noti che per la molecola di azoto, n2 o Nthn, i loro atomi rappresentati da sfere bluastri sono molto vicini tra loro.
Nel triplo collegamento abbiamo tre coppie di elettroni, che sono uguali a sei elettroni che rafforzano il legame covalente tra i due atomi.
-
Dativo
Il collegamento dativo è un tipo speciale di link semplice che consiste nella coppia di elettroni proviene solo da uno dei due atomi collegati. Cioè, potrebbe essere visto come una "condivisione forzata".
Ad esempio, la molecola M2O usa una delle coppie senza ossigeno per donarle a uno ione H+ (H2O: → H+ = [H2OH]+ o h3O+).
Secondo la polarità
I legami covalenti in base alla polarità possono essere classificati come covalenti polari o non polari.
-
Legami covalenti polari
Si verifica tra due atomi diversi la cui differenza di elettronegatività è grande. Ciò si traduce nella formazione di un dipolo, in cui un atomo si concentra negativamente (attira elettroni), mentre l'altro si concentra positivamente (produce elettroni). Ad esempio, il legame covalente HF (H-F) è polare, perché il fluoro è più elettronegativo dell'idrogeno.
-
Collegamenti covalenti non polari
Si verifica tra due atomi identici la cui differenza di elettronegatività è zero o molto piccola. Le molecole sopra menzionate: i2, O2 e n2 Presentano legami covalenti non polari. Pertanto, gli elettroni sono in giro per entrambi gli atomi con la stessa frequenza.
Può servirti: uretano: struttura, proprietà, ottenimento, usiEsempi di collegamenti covalenti
Infine, verranno elencati altri legami covalenti in aggiunta a quelli già spiegati, che indicano anche i loro tipi:
H2S (H-S-H), semplice covalente polare | HCl (H-Cl), collegamento covalente polare semplice |
H2 (H-H), non polare semplice covalente | C2H4 (H-C≡C-H), con due semplici collegamenti polari (C-H) e un triplo collegamento non polare (C≡C) |
F2 (F-F), semplice covalente non polare | P2 (p≡P), legame covalente non polare (o apolare) |
CO₂ (O = C = O), doppio polare covalente | S2 (s = s), legame doppio covalente non polare |
HCN (H-C≡N), con un semplice legame covalente polare (H-C) e un altro triplo collegamento polare (c≡N) | NH3 (N-H), con tre semplici legami covalenti polari |
Gli esempi citati corrispondono a piccole molecole. Ma i legami covalenti sono presenti in tutte le molecole esistenti, tra cui polimeri, biomolecole, macromolecole, minerali, ceramiche, idrocarburi, tra molti altri.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- María Estela Raffino. (28 giugno 2020). Legame covalente. Concetto.Di. Recuperato da: concetto.Di
- Wikipedia. (2020). Legame covalente. Recuperato da: in.Wikipedia.org
- Camy fung & nima mirzaee. (15 agosto 2020). Legami covalenti. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (27 agosto 2020). Cos'è un legame covalente in chimica? Recuperato da: Thoughtco.com

