Equazione di Arrhenius
- 4721
- 1152
- Kayla Serr
Qual è l'equazione di Arrhenius?
IL Equazione di Arrhenius È un approccio che mette in relazione la costante di velocità di una reazione chimica a seconda della temperatura. Fu fondato nel 1899 dal chimico svedese Svante Arrhenius (1859-1927). Rappresenta uno dei contributi fondamentali nello sviluppo della cinetica chimica.
Questa equazione deve le sue basi teoriche a numerosi scienziati, tra cui Wihelmy (1850), Berthelot (1862) e J. J. Hood (1885). Ma la più grande influenza è attribuita alla creazione dell'equazione di Arrhenius al lavoro svolto da Van't Hoof (1884), che ha stabilito una dipendenza dalle costanti di equilibrio delle reazioni chimiche con la temperatura.
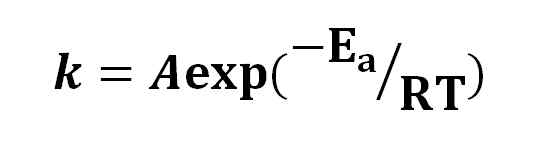 Equazione di Arrhenius. Fonte: Gabriel Bolívar.
Equazione di Arrhenius. Fonte: Gabriel Bolívar. Sulla base dell'equazione di Arrhenius, l'idea che un aumento di 10 ºC abbia causato una duplicazione della velocità di reazione è stata diffusa. Altre interpretazioni che diventano è che le molecole hanno bisogno di un po 'di energia di attivazione per reagire tra loro.
Allo stesso modo, si sottolinea che l'equazione di Arrhenius è un'altra forma di disintegrazione esponenziale in cui il valore della costante di velocità a seconda dell'esponente -eA/Rt, dove EA è l'energia di attivazione.
Equazione e spiegazione
L'equazione di Arrhenius ha le seguenti due espressioni:
K = ae-Ea/rt
Forma dell'equazione utilizzata in chimica ed è correlata alle talpe di reagente.
K = ae-EA/KBT
Forma dell'equazione utilizzata in fisica ed è correlata alle molecole più che con le moli.
Entrambi derivano dall'equazione dello zoccolo di van per la variazione della costante di equilibrio k a seconda della temperatura. L'equazione di base è:
d (ln k)/dt = eA/Rt2
Può servirti: Dibenzalacetona: proprietà, meccanismo di reazione, usi, rischiChe è integrato presupponendoloA è indipendente dalla temperatura. Quindi, abbiamo:
ln k = - eA/Rt + ln a
Dove ln a è la costante di integrazione. Quando la funzione esponenziale viene applicata su entrambi i lati dell'equazione, otteniamo l'equazione di Arrhenius già introdotta.
Componenti
K
È la costante di velocità di una reazione chimica. Il suo valore può essere ottenuto, oltre all'uso dell'equazione di Arrhenius, mediante l'applicazione della legge di velocità. Rappresenta il numero di collisioni tra le particelle prodotte da una reazione al secondo.
A
È il cosiddetto fattore pre-esponenziale, che rappresenta la frequenza delle collisioni tra molecole di reagente con un orientamento geometrico appropriato che può o non può produrre una reazione chimica. Se la variazione di temperatura è di scarsa grandezza, di solito viene considerata costante. Questo fattore ha la sua formula:
A = z ρ
Dove z è noto come fattore di frequenza o di collisione e ρ il fattore geometrico o sterico che indica l'orientamento relativo delle molecole nel punto di collisione. La costante A ha le stesse unità della costante di velocità. Nel caso in cui non vi sia energia di attivazione, l'entità di A sarà uguale a quella di K.
EA
È l'energia di attivazione, che rappresenta l'energia della soglia prima di raggiungere la statistica di transizione.
L'energia di attivazione ha l'unità KJ/mol. Ma nei calcoli il j/mol viene usato come unità. Il segno minimo (-) che precede la EA, Serve a indicare che il suo aumento produce una diminuzione della velocità di reazione, così come la sua riduzione produce un aumento della velocità di reazione.
Può servirti: gascromatografiaRt
Rappresenta l'energia cinetica media. Nel frattempo, R è la costante universale dei gas, essendo uno dei suoi valori più usati 8.31 J · K-1· Mol-1. E T è la temperatura assoluta espressa in Kelvin (K).
E
È la base dei logaritmi naturali o neperiani, con un valore di 2.71828.
E-Ea/rt
È la frazione di molecole di reazione con energia uguale o in eccesso in relazione all'energia di attivazione.
Applicazioni
La maggior parte delle applicazioni dell'equazione di Arrhenius proviene dall'uso nella determinazione della costante di velocità; e per estensione, la velocità della reazione, nonché la sua energia di attivazione.
Ad esempio, è stato sviluppato un modello chimico basato sull'equazione di Arrhenius, che può prevedere le proprietà dei materiali come variazione della temperatura, applicati nei campi di geologia, costruzione, ingegneria dei materiali e nelle scienze alimentari.
È stato applicato, sebbene con alcune critiche, l'equazione di Arrhenius nella cinetica delle reazioni allo stato solido. È stato anche usato per caratterizzare le risposte delle piante allo stress idrico.
L'equazione di Arenhius è stata la base per la creazione di un modello matematico, che quantifica l'effetto della temperatura sulla vita utile delle cellule o batterie idruro metalliche nichel.
Allo stesso modo, in base all'equazione di Arrhenius, è stato stabilito il tasso di decomposizione dei rifiuti di maiale e l'olio da cucina, sotto vari contenuti di umidità.
Esercizi risolti
Esercizio 1
Qual è l'energia di attivazione di una reazione se si trova che la sua costante di velocità triplica quando la temperatura sale da 600 K a 610 K?
Può servirti: acido fenossiacetico: sintesi, procedura, usi, rischiA partire dall'equazione di Arrhenius:
k = a · e-Ea/rt
Canconiamo il fattore A:
A = k1 / (e-EA/RT1)
Ma dal momento che abbiamo due temperature, T1 e T2, Ci saranno due costanti di velocità: k1 e k2. Il fattore A non cambia, quindi possiamo abbinarlo alla seconda temperatura:
K1 / (e-EA/RT1) = k2 / (e-EA/RT2)
E cancellare eA avremo:
EA = R (ln k2/K1) / (1 / t1 - 1/t2)
Tipo cosa2 è tre volte più grande di k1,
K2 / K1 = 3
ln (3) = 1.099
E d'altra parte:
1 / t1 = 1/600 K = 1.66 x 10-3 K-1
1 / t2 = 1 /610 K = 1.64 x 10-3 K-1
Sostituire allora:
EA = (8.31 J · K-1· Mol-1) (1.099) / (1.66 x 10-3 K-1 - 1.64 x 10-3 K-1)
= 456.5 kJ · mol-1
Esercizio 2
In una reazione di fase gassosa, l'energia di attivazione è pari a 103 kJ/mol e la costante di velocità è 0.085 min-1. Calcola la costante di velocità a 323 K.
Dall'espressione precedente eliminiamo ln k2/K1:
ln k2/K1 = (EA/R) (1 /t1 - 1/t2)
Sviluppare la parte giusta dell'equazione:
ln k2/K1 = (103.000 J · mol-1 / 8.31 J · K-1· Mol-1) (1/273 K - 1/323 K)
ln k2/K1 = 6.99
Prendendo antilogaritmi:
K2/K1 = 1.086
K2 = (k1) (1.086)
= (0.085 min-1) (1.086)
= 0.092 min-1
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Walter J. Moore. (1963). Chimica fisica. In cinetica chimica. Quarta edizione, Longmans.
- Iran. Levine. (2009). Principi di fisica. Sesta edizione. Mc Graw Hill.
- Wikipedia. (2020). Equazione di Arrhenius. Recuperato da: in.Wikipedia.org
- Guenevieve del Mundo et al. (10 settembre 2020). Equazione di Arrhenius. Recuperato da: Chem.Librettexts.org
- Clark Jim. (2013). Valuta le costanti e l'equazione di Arrhenius. Recuperato da: ChemGuide.co.UK
- I redattori di Enyclopedia Britannica. (2020). Equazione di Arrhenius. Recuperato da: Britannica.com
- Helmestine, Anne Marie, PH.D. (28 agosto 2020). La formula e esempio di equazione di Arrhenius. Recuperato da: Thoughtco.com

