Struttura di biossido di zolfo (SO2), proprietà, usi, rischi

- 5029
- 1390
- Dante Morelli
Lui diossido di zolfo È un composto inorganico gassoso formato da zolfo (s) e ossigeno (O), essendo la sua formula chimica così2. È un gas incolore con odore irritante e soffocante. Inoltre, è soluzioni di acido che formano acqua. I vulcani lo espelleranno verso l'atmosfera durante le eruzioni.
Fa parte del ciclo biologico e geochimico dello zolfo, ma è prodotto in grandi quantità da alcune attività umane come la raffinazione del petrolio e la combustione dei combustibili fossili (ad esempio carbone o diesel).
 Biossido di zolfo così2 viene emesso dai vulcani durante le eruzioni. Brocken Inaglory [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Biossido di zolfo così2 viene emesso dai vulcani durante le eruzioni. Brocken Inaglory [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Il SO2 È un agente riducente che consente alla polpa di carta di rimanere bianca dopo il riciclaggio di denaro con altri composti. Serve anche ad eliminare i resti di cloro nell'acqua che è stato trattato con questo chimico.
Viene utilizzato per mantenere alcuni tipi di cibo, per disinfettare i contenitori in cui si verifica la fermentazione del succo d'uva per produrre vino o orzo per preparare la birra.
Viene anche usato come fungicida in agricoltura, per ottenere acido solforico, come solvente e come intermediario nelle reazioni chimiche.
Il SO2 Presente nell'atmosfera è dannoso per molte piante, nell'acqua il pesce colpisce ed è anche uno dei responsabili della "pioggia acida" che corrode i materiali creati dall'essere umano.
[TOC]
Struttura
La molecola di biossido di zolfo è simmetrica e forma un angolo. L'angolo è perché il SO2 Ha un paio di elettroni solitari, cioè elettroni che formano il collegamento con qualsiasi atomo ma sono gratuiti.
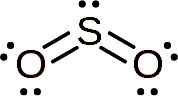 Struttura di lewis di anidride solforosa dove si osservano la sua forma angolare e la coppia di elettroni liberi. WhittleMario [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Struttura di lewis di anidride solforosa dove si osservano la sua forma angolare e la coppia di elettroni liberi. WhittleMario [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Nomenclatura
- Diossido di zolfo
- Anidride di zolfo
- Ossido solforoso.
Proprietà
Stato fisico
Gas incolore.
Peso molecolare
64,07 g/mol
Punto di fusione
-75,5 ºC
Punto di ebollizione
-10,05 ºC
Densità
Gas: da 2,26 a 0 ° C (rispetto all'aria, cioè densità d'aria = 1). Ciò significa che è più pesante dell'aria.
Liquido: 1.4 a -10 ° C (rispetto all'acqua, cioè densità dell'acqua = 1).
Solubilità
Solubile in acqua: 17,7% a 0 ° C; 11,9% a 15 ° C; 8,5% a 25 ° C; 6,4% a 35 ° C.
Solubile in etanolo, dietetica, acetone e cloroformio. È meno solubile nei solventi non polari.
ph
Le soluzioni acquose SOS2 Sono acidi.
Proprietà chimiche
Il SO2 È un potente agente riducente e ossidante. In presenza di aria e un catalizzatore si ossida così3.
SW2 + O2 → Quindi3
Le coppie di elettroni solitari a volte si comportano come una base di Lewis, in altre parole, può reagire con i composti in cui c'è un atomo che manca elettroni.
Può servirti: archiviazione di ferro: proprietà, come sono realizzate, tossicità, usiSe è così2 È sotto forma di gas e asciutto non attacca ferro, acciaio, leghe di nichel rame o nichel-crome-idro. Tuttavia, se si trova in uno stato liquido o umido, produce corrosione a questi metalli.
Il SO2 Il liquido con l'acqua allo 0,2% o più produce una forte corrosione di ferro, ottone e rame. È corrosivo per l'alluminio.
Quando è liquido puoi anche attaccare alcune materie plastiche, gomma e rivestimenti.
Sos acquoso di So2
Il SO2 È molto solubile in acqua. È stato considerato a lungo che nell'acido zolfo dell'acqua forma h2SW3, Ma l'esistenza di questo acido non è stata dimostrata.
In So Solutions2 In acqua si verificano i seguenti saldi:
SW2 + H2O ⇔ così2.H2O
SW2.H2O ⇔ hso3- + H3O+
HSO3- + H2O ⇔ così32- + H3O+
Dove hso3- È lo ione bisolfito e il SO32- È lo ione solfito. Lo ione solido così32- Si verifica principalmente quando un alcali viene aggiunto alla soluzione SO2.
Le soluzioni acquose SOS2 Hanno delle proprietà riducenti, soprattutto se sono alcaline.
Altre proprietà
- È estremamente stabile rispetto al calore, anche fino a 2000 ° C.
- Non è infiammabile.
Ottenimento
Il SO2 È ottenuto dalla combustione dello zolfo nell'aria, sebbene si formino anche piccole quantità di forma così3.
S + o2 → Quindi2
Può anche essere prodotto riscaldando nell'aria di vari solfuri, bruciando minerali di pirite e minerali contenenti solfuri, tra gli altri.
Nel caso della pirite di ferro, quando si ossidano l'ossido di ferro (III) e si ottengono2:
4 Fes2 + 11 o2 → 2 Faith2O3 + 8 Quindi2↑
Presenza in natura
Il SO2 Viene rilasciato nell'atmosfera dall'attività dei vulcani (9%) ma ha anche origine da altre attività naturali (15%) e dalle azioni umane (76%).
Le eruzioni vulcaniche esplosive causano significative fluttuazioni o variazioni annuali2 nell'atmosfera. Si stima che il 25% del SO2 Emesso dai vulcani viene lavato per pioggia prima di raggiungere la stratosfera.
Le fonti naturali sono le più abbondanti e sono dovute al ciclo biologico dello zolfo.
Nelle aree urbane e industriali, predominano le fonti umane. La principale attività umana che la produce è la combustione di combustibili fossili, come carbone, benzina e diesel. Altre fonti umane sono raffinerie di petrolio, impianti chimici e produzione di gas.
 Attività umane come il combustione del carbone per l'elettricità sono fonte di inquinamento con così2. Adrem68 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Attività umane come il combustione del carbone per l'elettricità sono fonte di inquinamento con così2. Adrem68 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Nei mammiferi viene generato in modo endogeno, cioè all'interno del corpo di animali e umani a causa del metabolismo degli aminoacidi contenenti zolfo, in particolare L-cisteina.
Può servirti: elementi liquidi: cosa sono ed esempiApplicazioni
Nella produzione di acido solforico
Una delle applicazioni più importanti del SO2 È nell'ottenere l'acido solforico h2SW4.
2 Quindi2 + 2 h2O + o2 → 2 h2SW4
Nell'industria alimentare trasformata
Il biossido di zolfo è usato come conservante alimentare e stabilizzatore, come agente per il controllo dell'umidità e come modificatore di sapore e consistenza di alcuni prodotti commestibili.
Viene anche utilizzato per disinfettare le attrezzature che entrano in contatto con generi alimentari, attrezzature di fermentazione, come birrifici e vitali, contenitori per alimenti, ecc.
Permette di conservare frutta e verdura, aumenta la sua vita sullo scaffale del supermercato, impedisce la perdita di colore e sapore e aiuto nella ritenzione della vitamina C (acido ascorbico) e del carotene (precursori della vitamina A).
 I frutti secchi rimangono liberi da funghi e batteri grazie al SO2. Autore: Isabel Ródenas. Fonte: Pixabay.com
I frutti secchi rimangono liberi da funghi e batteri grazie al SO2. Autore: Isabel Ródenas. Fonte: Pixabay.com Serve a mantenere il vino, perché distrugge batteri, funghi e lieviti indesiderati. Viene anche usato per sterilizzare e prevenire la formazione di nitrosamine nella birra.
 L'attrezzatura di fermentazione dell'orzo per ottenere la birra sterilizza con così2. Autore: Ceridebbie. Fonte: Pixabay.
L'attrezzatura di fermentazione dell'orzo per ottenere la birra sterilizza con così2. Autore: Ceridebbie. Fonte: Pixabay. Viene anche usato per immergere i cereali di mais, per sbiancare lo zucchero di barbabietola e come antimicrobico nella produzione di sciroppo di mais ad alto contenuto di fruttosio.
Come solvente e reattivo
È stato ampiamente usato come solvente non acquoso. Sebbene non sia un solvente ionizzante, è utile come solvente privo di protoni per alcune applicazioni analitiche e reazioni chimiche.
Viene usato come solvente e reagente nell'intermediario organico nella produzione di altri composti come il biossido di cloro, l'acetil cloruro e la solfonazione dell'olio.
Come agente riducente
È usato come agente riducente nonostante non sia così forte e in soluzione alcalina si forma lo ione solfito che è un agente riducente più energico.
In diverse applicazioni
Il SO2 Viene anche usato:
- In agricoltura come il fungicida e il conservante dell'uva dopo la raccolta.
- Per produrre idrosolfito.
- Per cannare la polpa di legno e carta, poiché consente di stabilizzare la polpa dopo il riciclaggio con perossido di idrogeno H2O2; Il SO2 Atti distruggendo H2O2 residuo e quindi mantieni la luminosità della polpa, come h2O2 può causare un'inversione di luminosità.
- Per candeggiare le fibre tessili e gli articoli di vimini.
- Per curare le acque, elimina il cloro residuo che rimane dopo la clorazione di acqua potabile, acque reflue o industriali.
- Nella raffinazione di minerali e metalli, come agente di riduzione del ferro durante l'elaborazione dei minerali.
- Nella raffinazione dell'olio per catturare ossigeno e ritardare la corrosione e come solvente di estrazione.
Può servirti: bilanciamento delle equazioni chimiche- Come antiossidante.
- Come neutralizzatore alcalis nella produzione di vetro.
- Nelle batterie al litio come agente ossidante.
Effetti di SO2 endogeno
Alcuni studi hanno rivelato che il SO2 Endogeno o prodotto dall'organismo stesso ha un effetto benefico sul sistema cardiovascolare, compresa la regolazione della funzione del cuore e il rilassamento dei vasi sanguigni.
Quando si verifica l'organismo2 Diventa i suoi derivati bisulfite hso3- e solfito così32-, che esercitano un effetto vasorelajador delle arterie.
Il SO2 Endogeno diminuisce ipertensione, impedisce lo sviluppo dell'aterosclerosi e protegge il cuore del danno al miocardio. Esercita anche un'azione antiossidante, inibisce l'infiammazione e l'apoptosi (morte cellulare programmata).
Per questi motivi si pensa che possa essere una possibile nuova terapia per le malattie cardiovascolari.
 Il cuore può beneficiare del SO2 prodotto dall'organismo. Autore: vettori di OpenClipart. Fonte: Pixabay.
Il cuore può beneficiare del SO2 prodotto dall'organismo. Autore: vettori di OpenClipart. Fonte: Pixabay. Rischi
- Esposizione a così2 Gaseous può portare a ustioni negli occhi, nella pelle, alla gola e alle mucose, danni a bronchi e polmoni.
- Alcuni studi riportano che ha un potenziale rischio di danno al materiale genetico dei mammiferi e delle cellule umane.
- È corrosivo. Non è infiammabile.
Ecotossicità
L'anidride solforosa è il gas inquinanti più comune nell'atmosfera, specialmente nelle aree urbane e industriali.
La sua presenza nell'atmosfera contribuisce alla così chiamata "pioggia acida" che è dannosa per gli organismi acquatici, il pesce, la vegetazione terrestre e la corrosione ai materiali realizzati dall'essere umano.
 Monumento danneggiato dalla pioggia acida. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikimedia Commons.
Monumento danneggiato dalla pioggia acida. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikimedia Commons. Il SO2 È tossico per i pesci. Le piante verdi sono estremamente sensibili a così2 atmosferico. Alfalfa, cotone, orzo e grano sono danneggiati con bassi livelli ambientali, mentre patate, cipolle e mais sono molto più resistenti.
Effetti dell'ingestione con il cibo
Sebbene sia innocuo per le persone sane, se utilizzate nelle concentrazioni raccomandate dalle agenzie sanitarie autorizzate, il SO2 può indurre l'asma a persone sensibili che lo ingeriscono con il cibo.
 Le persone sensibili possono soffrire di asma ingerendo cibo con piccole quantità di così2. Suraj a Malayalam Wikipedia [dominio pubblico]. Fonte: Wikimedia Commons.
Le persone sensibili possono soffrire di asma ingerendo cibo con piccole quantità di così2. Suraj a Malayalam Wikipedia [dominio pubblico]. Fonte: Wikimedia Commons. Gli alimenti che di solito lo contengono sono frutti secchi, bevande analcoliche artificiali e bevande alcoliche.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Zolfo di biossido. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Huang, e. et al. (2016). Biossido di zolfo endogeno: un nuovo dolce di famiglia gatrasmettitore nel sistema cardiovascolare. Oxid Med Cell Longev. 2016; 2016: 8961951. NCBI recuperato.Nlm.NIH.Gov.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Windholz, m. et al. (Redattori) (1983). L'indice Merck. Un eniclopedia di sostanze chimiche, farmaci e biologici. Decima edizione. Merck & co., INC.
- Pane, x. (2011). Ossidi Sulphur: fonti, esposizioni ed effetti sulla salute. Effetti sulla salute degli ossidi di zolfo. In enciclopedia della salute ambientale. Recuperato da ScienceDirect.com.
- Tricker, R. e truccatore, s. (1999). Inquinanti e contaminanti. Diossido di zolfo. In requisiti ambientali per le apparecchiature elettromeccaniche ed elettroniche. Recuperato da ScienceDirect.com.
- Bleam, W. (2017). Chimica acida-base. Ossidi zolfo. In chimica del suolo e ambientale (seconda edizione). Recuperato da ScienceDirect.com.
- Freedman, b.J. (1980). Biossido di zolfo negli alimenti e nelle bevande: usa un conservante e il suo effetto sull'asma. Br j dis torace. 1980; 14 (2): 128-34. NCBI recuperato.Nlm.NIH.Gov.
- Craig, k. (2018). Una revisione della chimica, dell'uso di pesticidi e del destino ambientale dell'anidride solforosa, utilizzato in California. Nelle revisioni di contaminazione ambientale e tossicologia. Volume 246. Link recuperato.Springer.com.
- « Struttura di silicio nitruro (SI3N4), proprietà, ottenimento, usi
- Struttura del poliloride in alluminio, proprietà, ottenimento, usi »

