Composto chimico
- 2124
- 178
- Baldassarre Ross
Spieghiamo in cosa consistono i composti chimici, i tipi che esistono, le differenze con gli elementi chimici e danno diversi esempi.
 I composti chimici sono tutta quella sostanza che ha atomi di due diversi elementi chimici
I composti chimici sono tutta quella sostanza che ha atomi di due diversi elementi chimici Cos'è un composto chimico?
UN composto chimico È una sostanza formata dall'unione di due o più atomi di diversi elementi chimici. I composti chimici rimangono uniti grazie ai legami chimici, che sono legati agli elettroni degli atomi collegati; cioè, in un composto chimico, gli elettroni (più esterni) degli atomi intervengono nella formazione dei collegamenti.
I componenti dei composti chimici (elementi chimici) non possono essere separati l'uno dall'altro con metodi fisici, come: distillazione, centrifugazione, filtrazione, ecc., richiedere metodi chimici in atto per raggiungerlo.
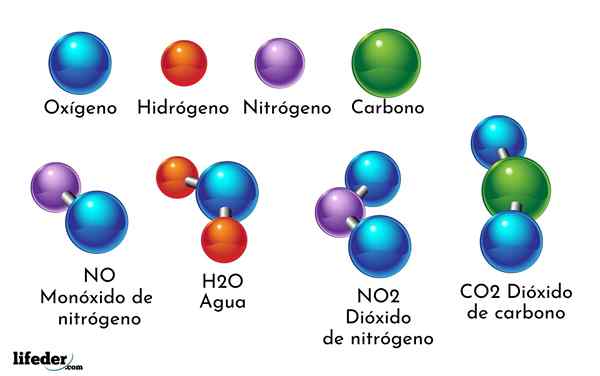
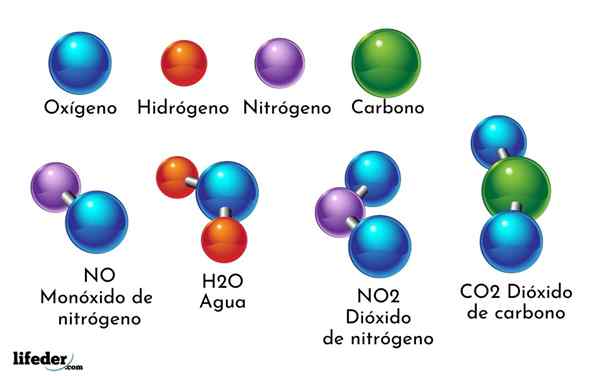
Un esempio di composto chimico è l'acqua. È formato solo da due atomi di due diversi elementi chimici: ossigeno e idrogeno, con la formula chimica H2O. Pertanto, due H si legano con uno o per formare H2O.
Un elemento chimico, a differenza dei composti chimici, è il modo più semplice e basilare che costituisce la materia. È presentato come un tipo unico di atomo che non può essere suddiviso in sostanze più semplici da reazioni chimiche.
Tipi di composti chimici
I composti chimici possono essere classificati principalmente seguendo due criteri:
- Secondo il tipo di legame che unisce gli elementi chimici presenti nel composto chimico.
- Secondo la composizione e la struttura del composto chimico.
Secondo il tipo di collegamento
A seconda del tipo di collegamento, i composti chimici possono essere:
- Molecole. Sono composti chimici formati da due o più tipi di diversi elementi chimici, che sono uniti da un legame covalente. Questo collegamento è caratterizzato dalla condivisione di una o più coppie di elettroni esterni, o Valencia, tra due atomi.
- Ioni. I composti chimici caricati elettricamente sono chiamati composti chimici ionici e i loro ioni sono uniti dal collegamento ionico. Questo legame si verifica quando si unisce un elemento chimico del tipo di metallo con un elemento chimico non metal.
- Composti intermetallici. È un tipo di lega di metallo che costituisce un materiale solido che si trova tra due o più elementi chimici in metallo per tenerli insieme.
- Coordinazione. Sono formati da un elemento metallico centrale, chiamato Centro di coordinamento, e che circondano una serie di molecole o ioni uniti noti come ligandi. L'emoglobina, ad esempio, è una proteina che si trova nei globuli rossi e che trasporta ossigeno nel sangue. L'emoglobina ha un composto di coordinamento chiamato Grupo Hemo. Al centro dell'Emo c'è un atomo di ferro che interviene nel trasporto di ossigeno attraverso l'emoglobina.
Secondo la composizione e la struttura
Secondo questo criterio, i composti chimici sono classificati come organici e inorganici.
- Composti organici. Sono composti il cui elemento chimico principale è il carbonio, che di solito formano collegamenti con atomi dello stesso carbonio e idrogeno. Tuttavia, sono anche presenti, sebbene in misura minore, ossigeno, azoto, zolfo, boro, fosforo, ecc. I composti organici possono essere:
- Alifatico. Le molecole dei composti alifatici possono avere forme lineari o cicliche, ovvero in forme chiuse come triangoli, quadrati, pentagoni, ecc. Possono avere legami di carbonio di tre tipi: semplice (c-c), doppio (c = c) o triplo (c Tutto).
- Aromatico. Sono composti ciclici che presentano alternativamente semplici legami carbonio e legami carbonio carbonio.
- Eterociclico. Sono composti che hanno una struttura ciclica, che può presentare la sostituzione di un atomo di carbonio con un altro elemento chimico (O, S, N, ecc.).
- Organometallico. Sono composti organici che possono presentare nei loro elementi di metallo di composizione.
- Polimeri. Sono grandi molecole (macromolecole) che sono formate da unità piccole e identiche che si ripetono in tutto il polimero e che sono chiamate monomerie.
- Composti inorganici. I composti inorganici, a differenza di quelli organici, non hanno il carbonio come elemento chimico centrale, ma piuttosto intervengono nella loro composizione la maggior parte degli elementi chimici noti. I composti inorganici possono essere:
- Ossidi di base. Sono formati dalla reazione di un elemento chimico in metallo, come sodio, calcio, ferro, rame, ecc., Con ossigeno. Ad esempio, l'ossido di sodio (NAO) è un ossido di base. Sono chiamati ossidi di base perché darà origine alle basi o agli idrossidi.
- Ossidi acidi. Hanno origine dalla reazione di un elemento chimico non metallico, come cloro, fluoro, zolfo, bromo, ecc., Con ossigeno. Ad esempio, ossido bromico (BR2O5) È un ossido acido. Sono chiamati ossidi acidi perché danno origine ad acidi.
- Idrori. Presentano nella loro composizione chimica la presenza di idrogeno. Esistono due tipi: idro metallico e idrori non metallici.
- Metallo. Sono formati dalla reazione di idrogeno, con lo stato di ossidazione -1, con un metallo. Questi composti chimici sono gli unici in cui l'idrogeno è presente con lo stato di ossidazione -1. Ad esempio, Cah2 È idruro di calcio.
- Non metallico. Sono formati dalla reazione di idrogeno, con stato di ossidazione + 1, con un elemento non metallico con il suo stato di ossidazione inferiore. L'idruro di cloro (HCl) è un gas che quando l'acido cloridrico viene sciolto in acqua.
- Acidi. Sono composti chimici inorganici, sebbene ci siano acidi organici, che hanno un pH inferiore a 7 e si rivolgono al colore della carta rossa a rosso. Possono essere classificati in idracicidi e ossacidi.
- Idrazia. Hanno origine dalla reazione di idrogeno con un non metal per formare un idruro che si dissolve nell'acqua proviene un acido; Ad esempio, acido iaridrico (HI).
- Oxcacidi. Origina la reazione di un ossido di un elemento chimico non metallico con acqua. Ad esempio, reazione di ossido solforico (SO3) Con acqua produce acido solforico (H2SW4).
- Esci. Sono composti chimici che hanno origine dall'interazione di acidi e composti di base. Nella sua composizione potrebbero esserci tanti elementi metallici quanto non metallici. I sali sono classificati come:
- Sali neutri. Hanno origine in una reazione di neutralizzazione tra un acido e una base con la formazione di sale e acqua. Ad esempio, la reazione di idrossido di sodio (NaOH) con acido cloridrico (HCl) produce cloruro di sodio (NaCl), sale e acqua. Sono chiamati neutrali perché non producono una variazione di pH.
- Sali acidi. Sono formati dalla reazione di un idrossido di metallo con Valencia +1, con un acido con diversi idrogeni. La reazione dell'idrossido di litio (Lioh) con acido carbonico (H2Co3), produce la sostituzione di un solo idrogeno con litio, che causa il bicarbonato di litio (Lihco3), Un sale acido e acqua.
- Sali di base. Sono prodotti dalla reazione di una base che ha più di un gruppo OH con un acido idrazia, ad esempio acido cloridrico. Quando reagi l'acido con idrossido di calcio, Ca (OH)2, Un atomo di cloro sostituisce un gruppo idrossile (OH). Ciò produce idrossicloruro di calcio (Cuckloh), un sale e acqua di base.
Differenze tra composti chimici ed elementi chimici
 Up the Chemical Elements e i composti chimici. I composti chimici sono formati dagli elementi sopra
Up the Chemical Elements e i composti chimici. I composti chimici sono formati dagli elementi sopra Ogni elemento chimico corrisponde a un atomo specifico e solo con quel tipo di atomo; Cioè, un elemento chimico non ha diversi tipi di atomi. L'atomo è la particella elementare della materia che non è divisa per metodi fisici o chimici.
L'atomo di un elemento chimico può essere unito agli atomi di altri elementi chimici per formare composti chimici, che possono essere separati nei loro componenti (elementi chimici) usando metodi chimici.
Gli elementi chimici e i composti chimici con un puzzle potrebbero essere attrezzati: i pezzi del puzzle hanno caratteristiche diverse, in modo che possano abbinare gli elementi chimici.
I pezzi del puzzle possono unirsi per formare figure diverse. Le figure formate potrebbero essere equiparate a composti chimici. Una volta terminata l'attività, le figure del puzzle possono essere separate nei pezzi che la costituiscono.
Esempi di composti chimici
Di seguito puoi vedere una serie di esempi di composti chimici quotidiani:
- HCL: acido cloridrico
- H2S: acido solfidrico
- HF: acido fluoridrico
- H2SW4: Acido solforico
- HCLO4: Acido perclorico
- H3Po4: Acido fosforico
- H2Co3: Acido carbonico
- Hno3: Acido nitrico
- NaOH: idrossido di sodio
- Ca (Oh)2: Idrossido di calcio
- Faith (Oh)2: Idrossido ferroso
- Faith (Oh)3: Idrossido ferrico
- Nah: idruro di sodio
- Cu2O: ossido cuproso
- CUO: ossido cupric
- Fede2O3: Ossido ferrico
- Cl2O7: Ossido perclorico
- Br2O: ossido hipobromoso
- Yo2O3: Ossido ipoyodosio
- NaCl: cloruro di sodio
- Fecl3: Cloruro ferrico
- HCO3: Bicarbonato di sodio
- Cap3Percorso: acetato di sodio
- N / a2SW4: Solfato di sodio
- Feso4: Solfuro ferroso
- H2O: acqua
- Co2: Diossido di carbonio
- C6H12O6: Glucosio
- C12H22Oundici: Saccarosio
Altri argomenti di interesse
Reazioni chimiche
Chimica nella vita di tutti i giorni: esempi
Composti organici
Composti inorganici
Legame chimico
Sostanze pure
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2021). Composto chimico. Recuperato da: in.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (27 agosto 2020). Definizione composta in chimica. Recuperato da: Thoughtco.com
- Toppr. (S.F.). Cos'è il composto in chimica? Tipi di composti chimici. Recuperato da: toppr.com

