Struttura, Proprietà, Proprietà di cloruro ferroso (FECL2)

- 3149
- 185
- Lino Lombardi
Lui cloruro ferroso È un solido inorganico formato dall'unione di una fede catione2+ e due anioni cloruro cl-. La sua formula chimica è Fecl2. Tende ad assorbire l'acqua dall'ambiente. Uno dei suoi idrati è Fecl Tetraidrato2 •4h2O che è un solido verdastro.
Evidenzia che è molto solubile in acqua e tende a ossidarsi facilmente in presenza di aria che forma il cloruro di fecl ferrico3. Per essere facilmente ossidabile e quindi in grado di agire come riduttore è ampiamente utilizzato nei laboratori di ricerca chimica e biologica.
 Ferroso Tetrahydrate cloruro Fecl2 •4h2O solido. Craven [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Ferroso Tetrahydrate cloruro Fecl2 •4h2O solido. Craven [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Il cloruro ferroso ha diversi usi tra cui aiutare altri agenti nell'ossidazione dei fanghi derivati dalle acque reflue o dal trattamento delle acque reflue. Viene anche utilizzato nel processo di rivestimento in ferro metallico e ha alcuni usi nell'industria farmaceutica.
È stato anche sperimentato l'uso di FECL2 Nel recupero di preziosi metalli dei catalizzatori esauriti trovati nei tubi di scarico dei veicoli che funzionano con benzina o diesel.
Viene utilizzato nel settore tessile per fissare i colori in alcuni tipi di tessuto.
[TOC]
Struttura
Il cloruro ferroso è formato da uno ione di fede ferroso2+ e due ioni cloruro cl- United attraverso collegamenti ionici.
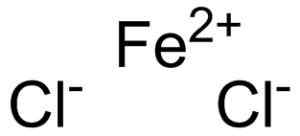 Ferroso Chloro Fecl2 Dove sono gli ioni che lo compongono. EPOP [dominio pubblico]. Fonte: Wikimedia Commons.
Ferroso Chloro Fecl2 Dove sono gli ioni che lo compongono. EPOP [dominio pubblico]. Fonte: Wikimedia Commons. La fede ferrosa2+ Ha la seguente struttura elettronica:
1s2, 2s2 2 p6, 3s2 3p6 3d6, 4s0
dove puoi vedere che hai perso due elettroni dello strato 4S.
Questa configurazione non è molto stabile, e per questo motivo tende ad ossidarsi, cioè perdere un altro elettrone, questa volta dello strato 3D, formando lo ione di fede3+.
Da parte sua il cloruro ionico cl- Ha la seguente struttura elettronica:
1s2, 2s2 2 p6, 3s2 3p6
dove puoi vedere che hai acquisito un ulteriore elettrone nel livello 3p, completandolo. Questa configurazione è molto stabile perché tutti i livelli elettronici sono completi.
Nomenclatura
- Cloruro ferroso
- Cloruro di ferro (II)
Può servirti: determinazione delle ceneri: metodi ed esempi- Dicloruro di ferro
- Cloruro ferroso tetraidrato: Fecl2 •4h2O
Proprietà
Stato fisico
Da colorato a verde pallido, cristalli.
Peso molecolare
126,75 g/mol
Punto di fusione
674 ºC
Punto di ebollizione
1023 ºC
Peso specifico
Da 3,16 a 25 ºC/4 ºC
Solubilità
Molto solubile in acqua: 62,5 g/100 ml a 20 ºC. Solubile in alcol, acetone. Leggermente solubile in benzene. Praticamente insolubile in etere.
Altre proprietà
Il fecl2 anidro è molto igroscopico. Assorbire l'acqua con facilità dell'ambiente, formando una varietà di idrati, in particolare il tetraidrato, in cui per ogni molecola FECL2 Ci sono 4 molecole2O collegato a questo (FECL2 •4h2O).
In presenza di aria si ossida lentamente per Fecl3. Ciò significa che lo ione di fede2+ Ossimila facilmente la fede ionica3+.
Se si riscuote in presenza di cloruro ferrico ad aria rapida Fecl3 E ossido ferrico Fe2O3.
Il fecl2 È corrosivo per metalli e tessuti.
Ottenimento
Si ottiene trattando un eccesso di fede di ferro con soluzione acquosa di acido cloridrico HCl ad alte temperature.
Fede0 + 2 HCL → FECL2 + 2 h+
Tuttavia, a causa della presenza di acqua attraverso questo metodo, si ottiene un cloruro di tetraidrato ferroso2 •4h2O.
Per ottenere anidro (senza acqua incorporata nei cristalli) alcuni ricercatori hanno scelto di eseguire la reazione della polvere di ferro con colline anidro (senza acqua) nel solvente tetraidrofuran (THF) a una temperatura di 5 ° C.
Il composto FECL si ottiene in questo modo2 •1,5 °, che quando riscaldato a 80-85 ºC nel vuoto o in atmosfera di azoto (per evitare la presenza di acqua) produce FeCL2 anidro.
Applicazioni
Il cloruro ferroso ha vari usi in base alla sua capacità di riduzione, cioè può essere facilmente ossidato. Viene utilizzato ad esempio in dipinti e rivestimenti, in quanto aiuta a ripararli dalla superficie.
Il ferro è un micronutriente essenziale per la salute umana e alcuni animali. È coinvolto nella sintesi proteica, nella respirazione e nella moltiplicazione delle cellule.
Pertanto il FECL2 È usato nei preparati farmaceutici. Lo ione di fede2+ In quanto tale è meglio assorbito dello ione di fede3+ Nell'intestino.
Può servirti: carbonato di calcio: struttura, proprietà, formazione, usiViene utilizzato per la produzione FECL3. Viene utilizzato in metallurgia, nei rivestimenti di ferro, per fornire un deposito più duttile.
Ecco altri usi di spicco.
Nella colorazione del tessuto
Il fecl2 È usato come fisso mordant o da colorare in alcuni tipi di tessuto. Il mordente reagisce chimicamente e si unisce simultaneamente al colorante e al tessuto che forma un composto insolubile su questo.
In questo modo, la tintura è fissata al tessuto e il suo colore si intensifica.
 Fecl di cloruro ferroso2 Consente ai colori di essere fissati su tessuti. Gina pina [CC di 2.0 (https: // creativeCommons.Org/licenze/by/2.0)]. Fonte: Wikimedia Commons.
Fecl di cloruro ferroso2 Consente ai colori di essere fissati su tessuti. Gina pina [CC di 2.0 (https: // creativeCommons.Org/licenze/by/2.0)]. Fonte: Wikimedia Commons. Nel trattamento delle acque reflue
Il fecl2 Viene utilizzato nelle acque reflue o negli impianti di trattamento dei rifiuti (acque fognarie).
In questa applicazione il cloruro ferroso partecipa all'ossidazione del fango, attraverso un processo chiamato ossidazione di Fenton. Questa ossidazione provoca la rottura dei cruscotti di fango e consente il rilascio di acqua fortemente attaccata a questo.
 Sezione di un impianto di trattamento delle acque reflue in cui puoi vedere il fango. A volte questo è trattato con cloruro di fecl di ferroso2 in modo che possa essere più facilmente separato dall'acqua. Evelyn Simak/Weaks Works a nord di Dickleburgh. Fonte: Wikimedia Commons.
Sezione di un impianto di trattamento delle acque reflue in cui puoi vedere il fango. A volte questo è trattato con cloruro di fecl di ferroso2 in modo che possa essere più facilmente separato dall'acqua. Evelyn Simak/Weaks Works a nord di Dickleburgh. Fonte: Wikimedia Commons. Quindi il fango può asciugare e scartare. L'uso di cloruro ferroso aiuta a ridurre i costi di processo.
È stato anche recentemente proposto per ridurre la formazione di gas solfuro o idrogeno solforato in dette fognature delle fogne.
In questo modo la corrosione prodotta da questo gas e gli odori spiacevoli sarebbe ridotta.
In studi chimici
Per le sue proprietà riducenti (l'opposto dell'ossidazione) la FECL2 È ampiamente utilizzato in varie ricerche in laboratori di chimica, fisica e ingegneria.
Alcuni scienziati hanno usato il vapore di cloruro ferroso.
Questi catalizzatori sono usati per eliminare i gas dannosi per l'essere umano e l'ambiente. Si trovano nel tubo di fuga di auto e camion che funzionano con benzina o diesel.
Può servirti: massa molare: come viene calcolato, esempi ed esercizi risolti Tubo di scarico di un veicolo in cui si osserva una sezione più voluminosa che è dove si trova il catalizzatore per convertire i gas dannosi in gas amichevoli con l'ambiente. Ahanix1989 a inglese Wikipedia [dominio pubblico]. Fonte: Wikimedia Commons.
Tubo di scarico di un veicolo in cui si osserva una sezione più voluminosa che è dove si trova il catalizzatore per convertire i gas dannosi in gas amichevoli con l'ambiente. Ahanix1989 a inglese Wikipedia [dominio pubblico]. Fonte: Wikimedia Commons. Dopo un certo tempo viene speso il catalizzatore per il veicolo e perde efficacia e devi sostituirlo. Il catalizzatore esaurito viene scartato e vengono fatti sforzi per recuperare i preziosi metalli che contiene.
 Griglia in ceramica del catalizzatore in cui si trovano le tracce di preziosi metalli da recuperare con FECL2. Riciclaggio globale-kat [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Griglia in ceramica del catalizzatore in cui si trovano le tracce di preziosi metalli da recuperare con FECL2. Riciclaggio globale-kat [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Secondo i ricercatori, con il ferro del cloruro ferroso questi metalli formavano leghe magnetiche.
Le leghe potrebbero essere estratte con magneti e quindi recuperate i metalli preziosi con metodi già noti.
In studi biochimici
Per possedere il catione di fede2+, che è un micronutriente importante nell'essere umano e alcuni animali, la FECL2 È usato in studi di biochimica e medicina.
Alcuni studi hanno permesso di dimostrare che il cloruro ferroso migliora l'efficacia fungicida del plasma freddo argon.
Il plasma freddo è una tecnologia utilizzata per la sterilizzazione di superfici mediche e strumenti. Si basa sulla formazione di radicali idrossilici oh · dall'umidità dell'ambiente. Questi radicali reagiscono con la parete cellulare del microrganismo e causano la loro morte.
In questa indagine la FECL2 L'effetto del plasma freddo ha migliorato e accelerato l'eliminazione di un fungo resistente ad altri metodi di disinfezione.
Alcuni scienziati hanno scoperto che l'uso di FECL2 Consente di aumentare le prestazioni nel glucosio ottenendo reazioni in base alla bagassa della canna da zucchero.
In questo caso, essere fede2+ Un microement essenziale per la salute umana, la sua presenza nelle tracce nel prodotto non influirebbe sull'essere umano.
Riferimenti
- Fukuda, s. et al. (2019). Il cloruro ferroso e il solfato ferroso migliorano l'efficacia fungicida del plasma di argon atmosferico freddo su aureobasidio pullulan melanizzato. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI recuperato.Clm.NIH.Gov.
- Ismal, o.E. e Yildirim, L. (2019). Gag e biomordanti di metallo. Nell'impatto e nelle prospettive della chimica verde per la tecnologia tessile. Capitolo 3, pp.57-82. Recuperato da ScienceDirect.com.
- Zhang, w. et al. (2019). Co-catalisi del cloruro di magnesio e cloruro ferroso per xilo-oligosaccaridi e produzione di glucosio dalla bagassa della canna da zucchero. BioResoral Technol 2019, 291: 121839. NCBI recuperato.Nlm.NIH.Gov.
- Zhou, x. et al. (2015). Ruolo del ferro indigeno nel miglioramento della disidrabilità dei fanghi questa perossidazione. Rapporti scientifici 5: 7516. NCBI recuperato.Nlm.NIH.Gov.
- Rathnayake, d. et al. (2019). Controllo dei solfuri idrogeno nelle fognature catalizzando la reazione con ossigeno. Science of the Total Environment 689 (2019) 1192-1200. NCBI recuperato.Nlm.NIH.Gov.
- Taninouchi e. e Okabe, T.H. (2018). Recupero di metalli del gruppo platino da catalizzatori esauriti usando il trattamento del vapore di cloruro di ferro. Metall e Materi Trans B (2018) 49: 1781. Link recuperato.Springer.com.
- O.S. Biblioteca nazionale di medicina. (2019). Cloruro ferroso. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- Aresta, m. et al. (1977). Ossidazione di ferro (0) per cloruro di idrogeno in tetraidrofurano: modo semplice per il cloruro di ferro anidro (II). Chimica inorganica, vol. 16, n. 7, 1977. Recuperato dai pub.sindrome coronarica acuta.org.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- « Portogallo Flag History and Significato (immagini riviste)
- Origine etica cristiana, fondamenti, rappresentanti »

