Cloruro di stagno (ii)
- 1307
- 222
- Enzo De Angelis
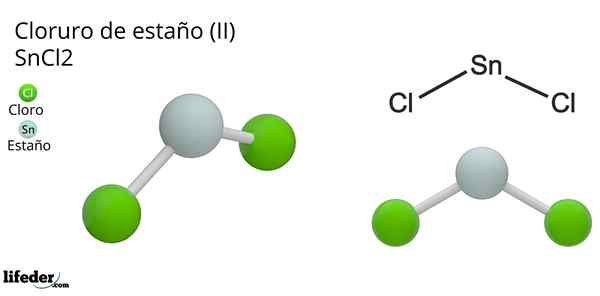
Lui Cloruro di latta (Ii) o piccolo cloruro, della formula chimica Sncl2, È un composto solido bianco e cristallino, prodotto della reazione stagno e una soluzione di acido cloridrico concentrato: SN (S) + 2HCl (Conc) => SNC2(aq) + h2(G). Il processo della sua sintesi (preparazione) consiste nell'aggiunta di pezzi di stagno per reagire con l'acido.
Dopo aver aggiunto i pezzi di stagno, la disidratazione e la cristallizzazione vengono eseguite fino a ottenere il sale inorganico. In questo composto, la scatola ha perso due elettroni del suo strato di valenza per formare collegamenti con atomi di cloro.
Questo può essere meglio compreso se viene considerata la configurazione di stagno Valencia (5s25 pX2PE0Pz0), di cui la coppia di elettroni che occupa l'orbitale pX è assegnato ai protoni H+, Per formare una molecola di idrogeno diatomico. Cioè, questa è una reazione di tipo redox.
[TOC]
Proprietà del cloruro di stagno
 Cloruro di stagno (ii) diidrato
Cloruro di stagno (ii) diidrato Collegamenti SNCL2 Sono di tipo ionico o covalente? Le proprietà fisiche del cloruro di stagno (II) scartano la prima opzione. I punti di fusione e ebollizione per questo composto sono 247 ºC e 623 ºC, indicativi di interazioni intermolecolari deboli, fatto comune per i composti covalenti.
I suoi cristalli sono bianchi, il che si traduce in zero assorbimento nello spettro visibile.
Configurazione Valencia
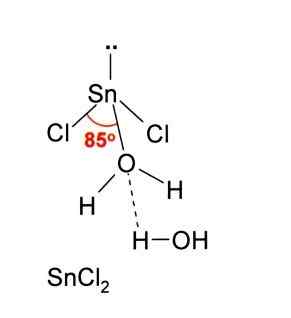
Nell'immagine sopra, è illustrata una menta isolata di snick2.
La geometria molecolare dovrebbe essere piatta perché l'ibridazione dell'atomo centrale è SP2 (3 SP Orbitali2 e un orbitale puro per formare legami covalenti), ma la coppia priva di elettroni occupa il volume e spinge gli atomi di cloro verso il basso, dando alla molecola una geometria angolare.
In fase gassosa questo composto è isolato, quindi non interagisce con le altre molecole.
Può servirti: saponificazioneCome perdita della coppia di elettroni nel P orbitaleX, Tin si trasforma in Sn Ion2+ e la sua configurazione elettronica risultante è 5s25 pX0PE0Pz0, Con tutti i suoi orbitali disponibili per accettare collegamenti da altre specie.
Cl ioni- Si coordinano con lo Sn ion2+ Per dare origine al cloruro di stagno. La configurazione elettronica di stagno in questo sale è 5s25 pX2PE2Pz0, Essere in grado di accettare un altro paio di elettroni nel tuo orbitale gratuito pz.
Ad esempio, puoi accettare un altro cl ionico-, Formando il complesso di geometria piatta trigonale (una piramide di base triangolare) e caricato negativamente [SNCL3"-.
Reattività
Lo sncl2 Ha un'elevata reattività e tendenza a comportarsi come acido Lewis (recettore degli elettroni) per completare il suo ottetto di Valencia.
Così come accettare un cl ione-, Lo stesso vale per l'acqua, che "idrata" l'atomo di stagno quando una molecola d'acqua è collegata direttamente alla stagno e una seconda molecola d'acqua forma interazioni da parte di ponti idrogeno con il primo.
Il risultato di questo è che lo sncl2 Non è puro, ma coordinato con l'acqua nel suo sale diidratato: Sncl2· 2h2O.
Lo sncl2 È molto solubile in acqua e solventi polari, perché è un composto polare. Tuttavia, la sua solubilità in acqua, inferiore al suo peso di massa, attiva una reazione di idrolisi (rottura di una molecola d'acqua) per generare un sale di base e insolubile:
Sncl2(aq) + h2O (l) Sn (OH) Cl (S) + HCl (AQ)
La doppia freccia indica che viene stabilito un equilibrio, favorito a sinistra (verso i reagenti) se le concentrazioni di HCL aumentano. Pertanto, soluzioni SNCL2 I dipendenti hanno un pH acido, per evitare le precipitazioni del prodotto salato indesiderato dell'idrolisi.
Può servirti: nucleofilo: attacco nucleofilo, tipi, esempi, nucleofiliaAttività riduttiva
Reagisce con l'ossigeno dell'aria per formare cloruro di stagno (IV) o cloruro è:
6 Sncl2(aq) + o2(g) + 2h2O (l) => 2Sncl4(AQ) + 4SN (OH) CL (S)
In questa reazione il stagno ossida che forma il collegamento con l'atomo di ossigeno elettronegativo e aumenta il suo numero di legami con atomi di cloro.
In generale, gli atomi elettronegativi degli alogeni (F, Cl, Br e I) stabilizzano i collegamenti dei composti Sn (IV) e questo fatto spiega perché SNCL2 è un agente riducente.
Quando ossidati e perde tutti i suoi elettroni di valenza, lo ione Sn4+ è la configurazione 5s05 pX0PE0Pz0, essendo la coppia di elettroni nell'orbitale 5S, il più difficile essere "portato via".
Struttura chimica del cloruro di stagno
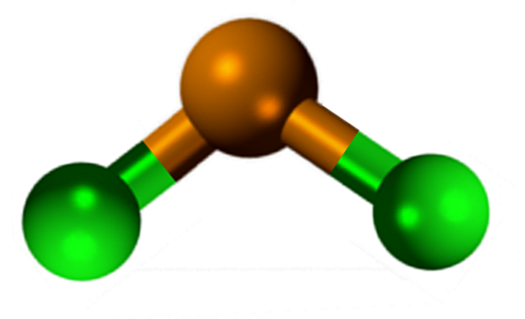 Struttura del cloruro di stagno (II)
Struttura del cloruro di stagno (II) Lo sncl2 Presenta una struttura cristallina di tipo ortorrombico, simile alle file di Serruchos, in cui le punte dei denti sono cloruri.
Ogni riga è una catena SNCL3 Formando un ponte Cl con un altro atom SN (CL-SN (CL)2-Cl- ···). Due catene, insieme a deboli interazioni del tipo Sn-Cl costituiscono uno strato della disposizione, che si sovrappone a un altro strato e così via fino a quando non definiscono il solido cristallino.
La coppia di elettroni gratuiti 5s2 Causare distorsione nella struttura perché occupa il volume (il volume della nuvola elettronica).
Il SN può avere un numero di coordinamento pari a nove, che è lo stesso di avere nove vicini, disegnando un prisma trigonale con questo situato al centro della figura geometrica e il CL nei vertici, oltre ad altri CL situati in ciascuno di le facce quadrate del prisma.
Può servirti: HydraceQuesto è più facile da osservare se è considerata una catena in cui il SN (sfere grigio scuro) indica e i tre Cl si collegavano a questa forma il pavimento triangolare, mentre i tre clienti formano il tetto triangolare superiore.
Usi/applicazioni
Nella sintesi organica è impiegato come agente riducente dei composti nitro aromatici (AR-NO2 à ar-nh2). Poiché la sua struttura chimica è laminare, trova uso nel mondo della catalisi delle reazioni organiche, oltre ad essere un potenziale candidato per il supporto catalitico.
La sua proprietà riducente viene sfruttata per determinare la presenza di composti d'oro, per coprire il vetro con specchi d'argento e per fungere da antiossidante.
Inoltre, nella sua piramide trigonale di geometria molecolare (: SNX3- M+) è usato come base di Lewis per la sintesi di un vasto numero di composti (come il complesso del cluster PT3Sn8Clventi, dove la coppia senza elettroni è coordinata con un acido Lewis).
Rischi
Lo sncl2 Puoi danneggiare i globuli bianchi. È corrosivo, irritante, cancerogeno e ha elevati impatti negativi sulle specie che abitano gli ecosistemi marini.
Può decomporsi ad alte temperature, rilasciando il gas di cloro dannoso. In contatto con agenti molto ossidanti innesca le reazioni esplosive.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. In Gli elementi del gruppo 14 (quarta edizione., P. 329). Mc Graw Hill.
- Libro chimico. (2017). Libro chimico: chimico.com
- PUBCHEM. (2018). Cloruro di latta. Pubchem recuperati: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2017). Stagno (ii) cloruro. Wikipedia recuperato: in.Wikipedia.org
- F. Hulliger. (1976). Chimica strutturale delle fasi di tipo strato. P-120.121. D. Reidel Publishing Company.

