Struttura di clorito di sodio (NACLO2), proprietà, usi, rischi

- 4477
- 237
- Dott. Rodolfo Gatti
Lui clorito di sodio È un solido inorganico formato da un sodio ione Na+ e un clorito ionico clo2-. La sua formula chimica è NaClo2. È un solido bianco cristallino, oltre ad essere un forte agente ossidante. Pertanto, deve stare molto attento.
Il suo uso principale è come agente disinfettante per molte applicazioni. Permette di eliminare i microbi su superfici come pavimenti, pareti e attrezzature di laboratorio negli ospedali e nelle cliniche e nei loro sistemi idrici.
 Naclo di clorito di sodio2 solido. Autore: ChemicalIrrest . Fonte: Wikimedia Commons.
Naclo di clorito di sodio2 solido. Autore: ChemicalIrrest . Fonte: Wikimedia Commons. Anche nelle strutture agricole e veterinarie, per igiencare incubatori di uova di uccelli, per controllare le infezioni delle vacche da latte, per disinfettare i sistemi idrici per animali, ecc.
Nell'industria alimentare le loro soluzioni acquose acidificate servono a lavare carne, polli, frutta, verdure e attrezzature di tali strutture.
Con clorito di sodio, può essere preparato il biossido di cloro2 Sul sito di utilizzo, che consente di eliminare microbi, cattivi odori e sapori d'acqua in modo che sia piacevole e possa bere senza problemi.
Serve anche a sbiancare la polpa di carta, fibre e oli tessili vegetali, tra le altre applicazioni.
Il Naclo2 Il solido deve essere gestito con cautela, perché a contatto con determinati materiali possono verificarsi esplosioni. Le loro soluzioni sono un po 'più facili da manipolare ma sono molto ossidanti e corrosivi.
[TOC]
Struttura
Il clorito di sodio è costituito da una nazione di sodio+ e un clorito di anione2- Pertanto sono uniti da un legame ionico.
L'anione di clorito ha un atomo di cloro in uno stato di ossidazione di +3 e due atomi di ossigeno con valencia -2 ciascuno. Per questo motivo l'anione di clorito ha un onere negativo.
Ha anche una struttura a forma di angolo.
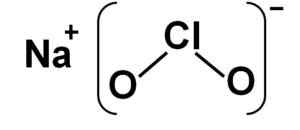 Struttura del clorito di sodio NaClo2. Autore: Marilú Stea.
Struttura del clorito di sodio NaClo2. Autore: Marilú Stea. Nomenclatura
- Clorito di sodio
- Clorito di sodio
- Sale di sodio di cloro
Proprietà
Stato fisico
Solido bianco cristallino.
Peso molecolare
90,44 g/mol.
Punto di fusione
Si decompone mentre si scioglie tra 180 e 200 ºC.
Densità
2.468 g/cm3
Solubilità
Acqua Solubile: 64 g/100 g di acqua a 17 ºC. Leggermente solubile in metanolo.
Altre proprietà
È leggermente igroscopico.
È un agente ossidante forte. Reagisce violentemente con materiali combustibili e riduttori. Reagisce violentemente con acidi, generando cloro biossido clo2.
Può servirti: regole di hume-rotheryLe sue soluzioni alcaline (significa in presenza di NaOH ad esempio) sono abbastanza stabili, mentre in mezzo acido si forma il cloro Acido HCLO2, che si decompone rapidamente:
4 HCLO2 → 2 CLO2↑ + clo3- + Cl- + 2 h+ + H2O
Rischi
Entrambi i Naclo2 Solido come le loro soluzioni acquose sono potenzialmente pericolose e richiedono molta cautela ed esperienza durante la loro manipolazione e conservazione.
Il Naclo2 Il solido può esplodere quando si entra in contatto con sostanze organiche tra cui guanti e indumenti, materiali per controlli come segatura e cotone di scarto, nonché oli e grassi.
La forma solida è quindi molto difficile da trasportare ed è preferita usarla sotto forma di soluzioni acquose.
Queste soluzioni sono estremamente corrosive. Dovrebbero preferibilmente mantenere un pH superiore a 8, cioè un pH alcalino.
Il Naclo2 accelera la combustione di composti o materiali infiammabili, al punto da poter formare miscele esplosive con questi.
Se riscaldato, emettere fumi tossici di acido cloridrico HCl e ossido di sodio NA2O. Se è esteso prolungato al calore o al fuoco, può sfruttare.
Ottenimento
È preparato a cominciare dalla riduzione chimica o elettrochimica del naclo di sodio3, In presenza di acido cloridrico HCl per produrre il diossido di cloro CLO2.
Quest'ultimo sta reagendo con il perossido di idrogeno H2O2 Nella soluzione acquosa di idrossido di sodio Naoh e una soluzione di clorito di sodio di sodio si ottiene2, che evapora e cristallizza il solido.
Può anche essere ottenuto passando per il gas di biossido di cloro2 Per una soluzione NaOH.
2 clo2 + 2 NaOH → NaClo2 + Naclo3 + H2O
Applicazioni
Come microbicida e disinfettante in più applicazioni
È un ingrediente di numerosi prodotti che servono a controllare batteri, funghi e fanghi o limo di alghe. I prodotti che lo contengono a questo scopo sono utilizzati in agricoltura, commercio, industria e residenze o case.
Funge da disinfettante di molti tipi di materiali e superfici.
In agricoltura, il pollame e le industrie simili sono superfici dure disinfettate, attrezzature, strutture per l'incubazione di uova di uccelli, serre per funghi come funghi e sistemi di acqua di acqua e acqua di raffreddamento per penne degli uccelli.
Ha un uso veterinario come disinfettante topico nel controllo della mastite dei bovini da latte, per immergere i capezzoli dell'animale. La mastite è un'infezione da tinte di mucche.
Può servirti: processo adiabatico: tipi, esempi, esercizi risolti A volte devi immergere le mucche in soluzioni di clorito di sodio per evitare infezioni in esse. Autore: Hans Braxmeier. Fonte: Pixabay.
A volte devi immergere le mucche in soluzioni di clorito di sodio per evitare infezioni in esse. Autore: Hans Braxmeier. Fonte: Pixabay. Viene anche utilizzato negli stabilimenti di ricerca naturale per decontaminare i laboratori.
Gli usi commerciali, industriali e medici includono la disinfezione di sistemi di ventilazione, superfici dure (come pavimenti, pareti, attrezzature di laboratorio) e sistemi idrici.
Nelle strutture sanitarie come cliniche e ospedali viene utilizzato per decontaminare camere, corridoi, aree di isolamento e sterilizzazione del materiale.
È anche utile per ignitisare negli stabilimenti in cui le persone subiscono trattamenti per la salute dell'acqua o della spa.
Nell'industria alimentare viene utilizzato come fumigante per conservare il cibo.
È usato sotto forma di clorito di sodio acidificato. Questo è prodotto aggiungendo acido alimentare (ad esempio acido citrico, acido fosforico, acido ruota o solfato di acido sodio) a una soluzione acquosa di clorito di sodio.
Il clorito di sodio acidificato ha proprietà antimicrobiche e viene utilizzato come soluzione di lavaggio o pollo o immersione, carne, verdure, frutta e prodotti marittimi. Anche in acqua per congelare pollo o uccelli.
Nelle famiglie consente di disinfettare le superfici dure, come pavimenti e bagni, sistemi di riscaldamento o aria condizionata e sistemi di circolazione dell'acqua della piscina.
 Per disinfettare le piscine è possibile utilizzare NaClo di clorito di sodio2. Autore: Age Global Group. Fonte: Pixabay.
Per disinfettare le piscine è possibile utilizzare NaClo di clorito di sodio2. Autore: Age Global Group. Fonte: Pixabay.  I prodotti contenenti clorito di sodio consentono i bagni. Autore: Michal Jarmoluk. Fonte: Pixabay.
I prodotti contenenti clorito di sodio consentono i bagni. Autore: Michal Jarmoluk. Fonte: Pixabay. Viene anche venduto in piccole bustine insieme ad altri composti per rilasciare gas e controllare gli odori nelle case.
Disinfettare l'acqua potabile
È usato nella purificazione dell'acqua da bere, funge da ossidante, migliorando il sapore e l'odore dell'acqua potabile.
Il clorito di sodio è ampiamente usato come precursore per la generazione di biossido di cloro CLO2 che serve a trattare l'acqua potabile per il consumo umano, cioè per eliminare microrganismi, odori e sapori spiacevoli e può bere.
Per generare clo2 HCL può essere usato:
5 Naclo2 + 4 HCl → 4 CLO2↑ + 5 NaCl + 2 h2O
Il clo2 È un agente antimicrobico di ossidante ad alta azione e ampio spettro. Cioè, agisce contro un gran numero di microrganismi.
Può servirti: nitrito di potassio (KNO2): struttura, proprietà e usiI microrganismi sono disattivati perché il CLO2 interferisce con importanti enzimi di questi e con le proteine delle membrane cellulari. Ha anche il vantaggio di non produrre composti di organocloro, che sono tossici.
Ci sono in vendita compresse di clorito di sodio miscelate con altri composti che vengono sciolti nell'acqua e producono immediatamente il CLO2 in modo controllato, disinfettando l'acqua.
 Il clorito di sodio viene utilizzato con altri composti per ottenere acqua potabile pronta per bere. Autore: Ulrike Leone. Fonte: Pixabay.
Il clorito di sodio viene utilizzato con altri composti per ottenere acqua potabile pronta per bere. Autore: Ulrike Leone. Fonte: Pixabay. Il problema principale del trattamento dell'acqua per rimuovere i sapori e gli odori attraverso CLO2 Si consiste in quel clorito tossico e sali di cloro si possono formare durante il trattamento.
Per la cura delle lenti a contatto
Il Naclo2 È un componente delle soluzioni utilizzate per disinfettare le lenti a contatto.
Viene utilizzata una combinazione NaClo2 e tracce (quantità molto piccole) di perossido di idrogeno H2O2.
Il h2O2 Stabilizzare il clo2 che si forma e la combinazione di entrambi è molto efficace contro batteri, funghi e lieviti. I prodotti che sono quindi sono cloruro di sodio, acqua e ossigeno, che sono innocui, il che significa che non sono dannosi per gli occhi.
Quando le lenti vengono rimosse dalla soluzione, NaClo2 residuo si decompone rapidamente in Nall e O2. Il perossido residuo non irrita l'occhio. Pertanto queste soluzioni sono molto sicure.
 Le soluzioni per disinfettare le lenti a contatto hanno clorito di sodio tra i loro ingredienti. Autore: Nieuw ~ Commonswiki. Fonte: Wikimedia Commons.
Le soluzioni per disinfettare le lenti a contatto hanno clorito di sodio tra i loro ingredienti. Autore: Nieuw ~ Commonswiki. Fonte: Wikimedia Commons. In varie applicazioni
Il clorito di sodio viene utilizzato per la preparazione di biossido di cloro2 per uso immediato in un gran numero di applicazioni di cui alcune sono state trattate nei paragrafi precedenti.
Serve a sbiancare la polpa di legno, tessuti come cotone, fibre di piante, oli, grassi, vernici, vernici, vernici e cere commestibili commestibili e non modibili.
È un componente di colliri e alcune soluzioni per il lavaggio orale.
Viene utilizzato nel settore della lavorazione in pelle e negli agenti per l'elettrodo metallico (rivestimento in metallo).
Riferimenti
- Williams, l. et al. (2019). Microbiologia, cura delle lenti e manutenzione. In Lenses a contatto (sesta edizione). Recuperato da ScienceDirect.com.
- O.S. Biblioteca nazionale di medicina. (2019). Clorito di sodio. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Gray, n.F. (2014). Biossido di cloro. Tecnologia di processo. In microbiologia delle malattie a base di acqua (seconda edizione). Recuperato da ScienceDirect.com.
- McKen, l. (2012). Introduzione a FoodRadition and Medical Sterilization. Biossido di cloro. Nell'effetto della sterilizzazione sulla plastica ed elastomeri (terza edizione). Recuperato da ScienceDirect.com.
- Ortenberg, e. e Telsch, B. (2003). Problemi di gusto e odore in acqua potabile. Nel manuale di acqua e microbiologia delle acque reflue. Recuperato da ScienceDirect.com.
- Karsa, d.R. (2007). Biocidi. Biossido di cloro. Nel manuale per la pulizia/decontaminazione delle superfici. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. VCH Verlagsgellschaft MBH.

