Struttura, funzioni, inibitori della citocroma C ossidasi
- 933
- 115
- Cosetta Messina
IL Citocroma C ossidasi È un complesso proteico enzimatico che può attraversare il doppio strato lipidico della membrana cellulare. È che siamo stati principalmente associati alla membrana interna dei mitocondri, essendo entrambi negli organismi procariotici (batteri), come negli eucarioti (unicellulare e multicellulare).
Chiamato anche complesso IV, questo enzima è vitale nelle funzioni metaboliche aerobiche degli organismi, poiché è essenziale nella catena di trasporto di elettroni in cui la cellula brucia gli zuccheri e cattura parte dell'energia rilasciata per conservare il trifosfato di adenosina o l'ATP.
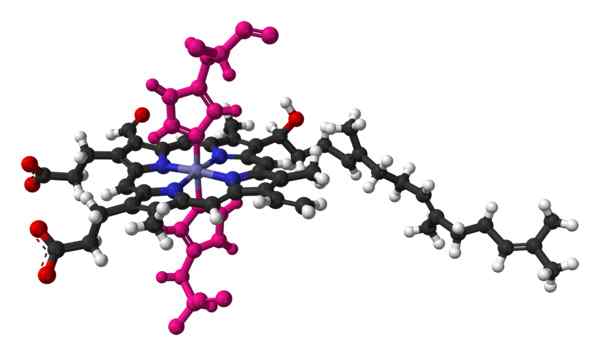
 Bola e Palo Modello dell'Emo, di una molecola trovata nella struttura cristallina del citocromo c ossidasi del cuore bovino. Preso e curato da: Benjah-BMM27 [dominio pubblico].
Bola e Palo Modello dell'Emo, di una molecola trovata nella struttura cristallina del citocromo c ossidasi del cuore bovino. Preso e curato da: Benjah-BMM27 [dominio pubblico]. Il nome del citocromo significa "pigmenti cellulari". Queste sono proteine del sangue che trasportano elettroni. I citocromi furono scoperti dal medico irlandese Charles Alexander MacMunn nel 1884. MacMunn è stato un pioniere nello scoprire il pigmento respiratorio del sangue, chiamato oggi citocromo 1.
Negli anni '20 del secolo entomologo russo e parassitologo. Sebbene MacMunn li avesse scoperti nel 1884, la comunità scientifica aveva dimenticato e persino alcuni avevano frainteso il loro lavoro.
[TOC]
Caratteristiche generali
In generale, i pigmenti respiratori hanno spettri visibili caratteristici. È noto che esistono almeno quattro complessi proteici di membrana completi in cui esistono 5 diversi tipi di citocromi: A, A3, B, C1 e C, classificati in base alle lunghezze d'onda dei massimi di assorbimento spettrale.
Di solito si trovano nella membrana interna dei mitocondri. Tuttavia, sono stati osservati anche nel reticolo e cloroplasti endoplasmatici, negli organismi eucariotici e procariotici.
Presentano il gruppo di protesi di emo contenente ferro (Faith). Ognuno dei citocromi noti agisce in complessi multienzimatici nel trasporto di elettroni della catena respiratoria.
I citocromi hanno la funzione di partecipare alle reazioni di riduzione dell'ossido. Le reazioni di riduzione, dove accettano elettroni, si verificano in modo diverso per ciascun tipo di citocromo e il loro valore è determinato dal flusso di elettroni a catena respiratoria.
-Cytocrome c
Sono noti quattro tipi di citocromo c, che sono i seguenti.
Classe I
All'interno di questa classe ci sono i citocromi C solubili di bassa svolta (lowspin), presenti nei batteri e nei mitocondri. Sono ottaedri. Il sito dell'Unione di Hemo è alla fine dell'istidina e il sesto ligando è fornito da un residuo di metionine alla fine c.
Da questa classe puoi persino riconoscere diverse sottoclassi, che sono state determinate la loro struttura a tre dimensioni.
Classe II
In questa classe ci sono citocromi C di High Turn (Highspin) e qualche turno basso. La svolta alte è il sito vincolante vicino alla fine-C, e in quelli con bassa svolta il sesto ligando sembra essere un residuo di metionina vicino all'estremità N-termus in inglese). Sono pentacoordinati con quinta ligando istidina.
Può servirti: turgidità (biologia)Classe III
Questa classe è caratterizzata dai citocromi C con HEMO multiplo (C3 e C7) e un a basso potenziale di ossido-reduttore, con solo 30 residui di aminoacidi per emo. Nei rappresentanti di questa classe, i gruppi di emozioni hanno una struttura e funzioni non equivalenti, oltre a presentare diversi potenziali redox. Sono ottaedri.
Classe IV
Secondo alcuni autori, questa classe è stata creata solo per includere proteine complesse presentate da altri gruppi protesici, nonché emozioni o flavocitocroma C, tra gli altri.
Il citocromo c ossidasi o il complesso IV
Il citocromo c ossidasi è un enzima mitocondriale che esegue la fase finale del trasporto elettronico nella respirazione cellulare. Questo enzima catalizza il trasporto di elettroni dal citocromo r ridotto all'ossigeno.
Alcuni composti chimici come cianuro, anidride carbonica e azide. Altre forme di inibizione del complesso IV sono le mutazioni genetiche.
Dal punto di vista evolutivo, il citocromo c ossidasi si trova solo negli organismi aerobici e diversi gruppi di scienziati suggeriscono che la presenza di questa proteina indica relazioni evolutive in cui piante, funghi e animali condividevano anche un antenato in comune.
Struttura
Il citocromo c ossidasi forma un complesso omodimerico, cioè composto da due monomeri simili nella membrana interna dei mitocondri. Il complesso enzimatico è costituito da 3 a 4 subunità negli organismi procariotici e fino a un massimo di 13 (alcuni suggeriscono 14) polipeptidi in organismi come i mammiferi.
In questi organismi 3 polipeptidi sono di origine mitocondriale e il resto ha origine nel nucleo. Ogni monomero ha 28 eliche transmembrane che separano i domini idrofili dalla matrice di membrana e nello spazio intermembrana.
Ha una sola unità catalitica, che si trova in tutti gli enzimi che catalizzano le reazioni di ossidazione/riduzione, usando ossigeno molecolare (ossidasi, in particolare emo-cobile). Il complesso contiene citocromi A e A3 uniti dalla subunità I e due centri di rame.
Presenta uno o più gruppi di emozioni collegati alla struttura proteica circostante da uno o più (generalmente due) collegamenti a tiroter. Altri autori suggeriscono che esiste un singolo gruppo di emozioni collegato alla proteina tra l'anello della porfirina e due residui di cisteina.
L'unico gruppo di emozioni di emozioni sopra menzionato, è circondato da rifiuti iodrophobici ed è esacoordininato, essendo istidina in posizione 18 della catena del polipeptide e metodo in 80.
Può servirti: cellula vegetale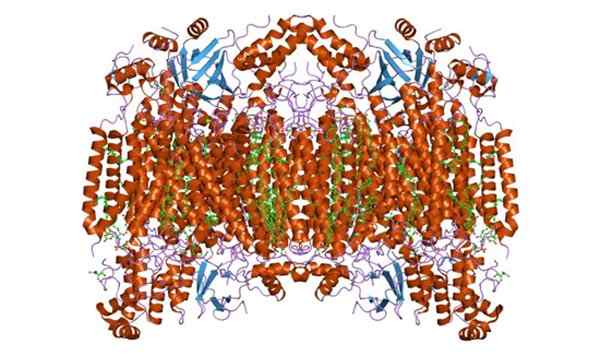 Subunità di citocromo c ossidasi F. Preso e curato da: Jawahar Swaminathan e Staff MSD presso l'European Bioinformatics Institute [Dominio pubblico]
Subunità di citocromo c ossidasi F. Preso e curato da: Jawahar Swaminathan e Staff MSD presso l'European Bioinformatics Institute [Dominio pubblico] Funzioni
Le citocroma c ossidasi sono protagonisti in tre meccanismi fisiologici primari, che vedremo di seguito.
Apoptosi o morte cellulare programmata
L'apoptosi è la distruzione o la morte cellulare programmata, causata dallo stesso organismo e questo mira a controllare la crescita, lo sviluppo, l'eliminazione dei tessuti danneggiati e la regolazione del sistema immunitario. In questo processo fisiologico il citocromo c ossidasi partecipa come intermediario.
Questa proteina, rilasciata dai mitocondri, porta a un'interazione con il reticolo endoplasmatico, che causa la secrezione o il rilascio di calcio. L'aumento progressivo del calcio innesca un massiccio rilascio di citocromo c ossidasi, fino a quando non è possibile raggiungere i livelli citotossici di calcio.
Livelli citotossici del calcio e il rilascio dei citocromi C causano l'attivazione in cascata di diversi enzimi, che sono responsabili della distruzione delle cellule.
Rigenerazione cellulare o tissutale
Diversi studi indicano che quando il citocromo c ossidasi è esposto a lunghezze d'onda di 670 nanometri, partecipa a un complesso funzionale, che penetra nel tessuto danneggiato o ferito e aumenta la velocità della rigenerazione cellulare.
Metabolismo energetico
Questa è forse la funzione più conosciuta e più rilevante del citocromo c ossidasi. È proprio il complesso di ossidasi (della catena respiratoria) che è responsabile della raccolta degli elettroni del citocromo C e li trasferisce alla molecola di ossigeno, riducendolo a due molecole d'acqua.
Collegato a questo processo, esiste una traslocazione di protoni attraverso la membrana, risultando nella generazione di un gradiente elettrochimico che il complesso di sintesi ATP utilizza per produrre o sintetizzare ATP (Adenosín Triffisphyte).
Inibitori
La citocroma C ossidasi è inibita da diversi processi e composti chimici. Il modo in cui si verifica può sorgere come un modo naturale per regolare la produzione o l'azione dell'enzima o può verificarsi accidentalmente a causa dell'avvelenamento.
In presenza di azide. Ciò provoca un'interruzione nel processo respiratorio cellulare e quindi provoca l'asfissiazione chimica delle cellule.
Un altro composto come ossido nitrico, idrogeno solforato, metanolo e alcuni alcoli metilati, causano anche inibizione del citocromo c ossidasi.
Carenza
Il citocromo c ossidasi è un enzima che è controllato da geni sia del nucleo che dei mitocondri. Esistono alterazioni o mutazioni genetiche che possono portare una carenza di citocromo c ossidasi.
Queste mutazioni disturbano la funzionalità dell'enzima, poiché alterano la loro struttura enzimatica, portando con sé disturbi metabolici durante lo sviluppo embrionale (secondo gli studi sull'uomo), che in seguito influenzerà l'organismo nei loro primi anni di vita.
Può servirti: cellule dendritiche: caratteristiche, funzione, tipiLa carenza di ossidasi del citocromo C colpisce i tessuti con alta domanda di energia, come cuore, fegato, cervello e muscoli. I sintomi di queste mutazioni si riflettono prima dei due anni di vita e possono manifestarsi come condizioni forti o lievi.
I sintomi lievi possono essere visti anche poco dopo il primo anno di età e di solito gli individui con loro hanno solo una diminuzione della tensione muscolare (ipotonia) e dell'atrofia muscolare (miopatia).
D'altra parte, gli individui che hanno sintomi più forti possono avere atrofia muscolare e encefalieopatia. Altre condizioni causate dall'assenza di citocromo c ossidasi sono la miocardiopatia ipertrofica, l'aumento patologico della dimensione del fegato, la sindrome di Leight e l'acidosi lattica.
Usi nella filogenesi
La filogenesi è la scienza che è responsabile degli studi di origine, formazione e sviluppo evolutivo dal punto di vista del discendente antenato, degli organismi. Negli ultimi decenni, gli studi di filogenesi con analisi molecolari sono stati sempre più frequenti, fornendo molte informazioni e risolvendo problemi tassonomici.
In questo senso, alcuni studi filogenetici indicano che l'uso di ossidasi di citocromo C può aiutare a stabilire relazioni evolutive. Questo perché questo complesso proteico è altamente conservato ed è presente in un'ampia varietà di organismi, che vanno dai protisti unicellulari, ai grandi vertebrati.
Esempio di ciò, sono i test eseguiti con umani, scimpanzé (Pane pane) e macachi rhesus (Mulatta Macaca). Tali test hanno rivelato che le molecole di citocromo c ossidasi di esseri umani e scimpanzé erano identici.
Ha anche dimostrato che le molecole del citocromo c ossidasi del macaco rhesus.
Riferimenti
- R.P. Ambler (1991). Variazione di sequenza nei cycromi batterici C. Biochimica et Biophysica Acta (BBA) - Bioenergetics.
- Cytocrome c. Recuperato da Newworldyclopedia.org.
- V.Colman, e. Costo. Chaves, v. Tortuara (2015). Ruoli biologici del citocromo C: trasporto elettronico mitocondriale, morte cellulare programmata e guadagno di attività AUS. Annali della facoltà di medicina.
- Citocromo c ossidasi subunità i. Recuperato da EBI.AC.UK.
- L. Youfen, p. Jeong-on, d. Jian-Hong e B. Yidong (2007). Il citocromo c ossidasi la subunità IV è essenziale per l'assemblaggio e la funzione respiratoria del complesso enzimatico. Journal of Bioenergetics e Biomembrane.
- Gruppo genico: complesso IV mitocondriale: citocromo c ossidasi (Cox, MT-CO). Recuperato dai genenames.org.
- E.F. Hartree (1973). La scoperta del citocromo. Educazione biochimica.
- Citocroma C ossidasi, carenza di .. . Recuperato da Ivami.com.
- C.K. Mathews, k.E. Van Hold & K.G. Ahern (2002). Biochemery. 3a edizione. Benjamin / Cummings Publishing Company, Inc.
- « Caratteristiche Opotillo, habitat, proprietà e parassiti
- Caratteristiche di Pinus Patula, Habitat, Taxonomy, Usi, Paraps »

