Ciclismo
- 619
- 74
- Lidia Valentini
 Cucloalquinos
Cucloalquinos Quali sono i cicloalquinos?
IL Ciclismo Sono composti organici, che hanno uno o più tripli collegamenti e un'unità ciclica. Le sue formule molecolari condensate obbediscono alla formula CNH2n-4. Pertanto, se n è uguale a 3, allora la formula di detto cicloalquino sarà C3H2.
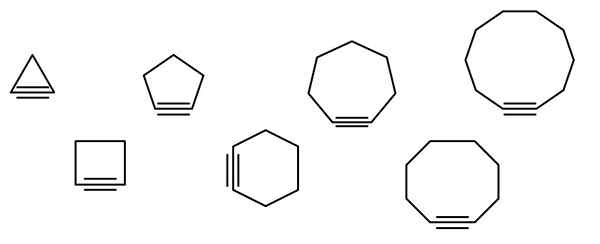
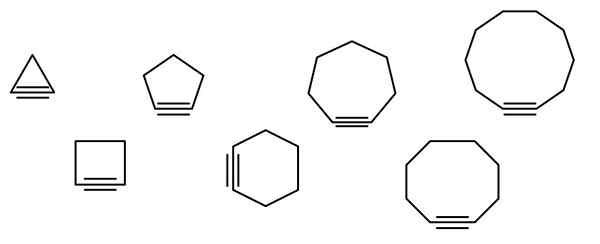
Nell'immagine superiore è illustrata una serie di figure geometriche, ma che in realtà consistono in esempi di cicloaldicini. Ognuno di essi può essere considerato una versione più ossidata dei rispettivi cicloalcani (senza collegamenti doppi o tripli). Quando mancano di un eteroátomo (o, n, s, f, ecc.), sono solo idrocarburi "semplici".
La chimica intorno ai cicloalquinos è molto complessa e ci sono ancora più meccanismi dietro le loro reazioni. Rappresentano un punto di partenza per la sintesi di molti composti organici, che a loro volta sono soggetti a possibili applicazioni.
In termini generali, sono molto reattivi a meno che non siano "distorti" o formano complessi con metalli di transizione. Inoltre, i loro tripli legami possono essere combinati con doppi legami, creando unità cicliche all'interno delle molecole.
Non essendo il caso, nelle loro strutture più semplici sono in grado di aggiungere piccole molecole ai loro tripli legami.
Caratteristiche dei cicloaldicini
Apoarità e triplo collegamento
I cyclesses sono caratterizzati da molecole apolari e quindi idrofobiche. Questo può cambiare se nelle loro strutture hanno qualche eteroátomo o gruppo funzionale che conferisce un notevole momento di dipolo; come negli eterocicli con tripli collegamenti.
Ma cos'è un triplo link? Non è altro che tre interazioni simultanee tra due atomi di carbonio con ibridazione SP. Un collegamento è semplice (σ) e gli altri due π, perpendicolari l'uno all'altro. Entrambi gli atomi di carbonio hanno un orbitale SP libero per collegare altri atomi (R-CESS.
Può servirti: radicale per l'affitto: come sono formati, nomenclatura, esempiQuesti orbitali ibridi hanno il 50% di S e il 50% del carattere p. Poiché l'orbitale S è più penetrante della P, questo fatto rende i due carboni del triplo legame più acidi (accettori di elettroni) rispetto ai carboni degli alcani o degli alcheni.
Per questo motivo, Triple Bond (≡) rappresenta un punto specifico per l'aggiunta di specie di donatori di elettroni a esso formando semplici collegamenti.
Ciò si traduce nella rottura di uno dei collegamenti π, diventando un doppio collegamento (C = C). L'aggiunta continua fino a r4C-cr4, cioè, carboni completamente saturi.
Quanto sopra può anche essere spiegato in questo modo: Triple Link è una doppia insaturazione.
Forze intermolecolari
Le molecole di cicloalcina interagiscono attraverso forze di dispersione o forze di Londra e per tipo di interazioni di tipo π-x. Queste interazioni sono deboli, ma con l'aumentare della dimensione dei cicli (come gli ultimi tre sul lato destro dell'immagine), riescono a formare solidi a temperatura e pressione ambientale.
Tensione angolare
I collegamenti a tripla collegamenti si trovano sullo stesso piano e una linea. Pertanto, -C≡C- ha una geometria lineare, con gli orbitali di circa 180º.
Ciò ha un serio coinvolgimento nella stabilità stereochimica dei cicloaldicini. È necessaria molta energia per "piegare" gli orbitali SP, poiché non sono flessibili.
Più piccolo è il cicloalquino, più gli SP orbitali devono essere piegati per consentire l'esistenza fisica dello stesso. Analizzando l'immagine, si può notare, da sinistra a destra, che nel triangolo l'angolo dei collegamenti ai lati del triplo collegamento è molto pronunciato; Mentre sono in Decagon sono meno bruschi.
Può servirti: blu di metilene: caratteristiche, preparazione, usiPoiché il cicloalquino è più grande, l'angolo di collegamenti dell'orbitale SP agli ideali 180º è più vicino. Il contrario accade quando sono più piccoli, costringendoli a piegarsi e creare un tensione angolare In essi, installando il cicloalquino.
Pertanto, i più grandi cicloaldicini hanno una tensione angolare inferiore, che consente la loro sintesi e conservazione. Con questo, il triangolo è il ciclo più instabile e il Decagon è il più stabile di tutti.
In realtà, il ciclooctina (l'ottagono) è quello con il più piccolo noto più stabile; Altri esistono solo come intermediari momentanei nelle reazioni chimiche.
Nomenclatura da ciclismo
Per nominare i cicli. L'unica differenza sta nel suffisso -ico alla fine del nome del composto organico.
La catena principale è quella che ha il triplo collegamento e inizia ad essere elencato dalla fine più vicina a questo. Se hai, ad esempio, ciclopropano. Se un gruppo metilico è collegato al vertice superiore, allora sarà: 2-metilciclopropino.
I carboni R-CESSO RI hanno già i loro quattro legami, quindi mancano di idrogeni (come per tutti i ciclhoalquins dell'immagine). Ciò non accade solo se il triplo collegamento è in una posizione terminale, cioè alla fine di una catena (R-CESS.
Applicazioni cicloalquine
I ciclocalcani non sono composti molto comuni, quindi nemmeno le loro applicazioni. Possono servire da leganti (gruppi che si coordinano) ai metalli di transizione, creando così un'infinità di composti organometallici che possono essere destinati a usi molto rigorosi e specifici.
Può servirti: bisolfito di sodio (NAHSO3): struttura, proprietà, usi, ottenimentoDi solito sono solventi nelle loro forme più sature e stabili. Quando sono costituiti da eterocicli, oltre ad avere unità cicliche CESS C = C-Cthc interno, trovano usi interessanti e promettenti come i farmaci antitumorali; Tale è il caso di Diemicine a. Altri composti con analogie strutturali ne hanno sintetizzato.
Esempi di cicochinos
L'immagine mostra sette semplici cicloaldicini, in cui non vi è quasi nessun triplo collegamento. Da sinistra a destra, con i rispettivi nomi che hanno: ciclopropino, triangolo; Ciclobutino, la piazza; Cycopentine, il Pentagono; ciclohexino, esagono; Cycloheptino, The Eptagon; Ciclooctino, l'ottagono; e Cyclodecin, il Decagon.
Sulla base di queste strutture e la sostituzione degli atomi di idrogeno dei carboni saturi, possono essere ottenuti altri composti da essi. Possono anche sottoporsi a condizioni ossidative per generare doppi collegamenti su altri lati dei cicli.
Queste unità geometriche possono far parte di una struttura più ampia, aumentando le possibilità di funzionalizzare l'intero set. Non ci sono molti esempi disponibili di cicloalcinos, almeno non senza approfondire le terre della sintesi organica e della farmacologia.
Riferimenti
- Francis a. Tartaruga. Chimica organica. (Sesta edizione., Pagina 372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cicloalkyne. Preso da: in.Wikipedia.org
- William Reusch. (05 maggio 2013). Nominare composti organici. Preso da: 2.Chimica.MSU.Edu
- Chimica inorganica. Ciclismo. Preso da: Fullquimica.com
- Patrizia Diana e Girolamo Cirrincione. (2015). Biosintesi degli eterocicli dall'isolamento al cluster genico. Wiley, pagina 181.
- Interessante chimica organica e prodotti naturali. (17 aprile 2015). Cicloalkynes. Preso da: quintus.Mickel.cap

