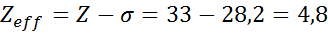Carico nucleare efficace
- 3423
- 261
- Dott. Rodolfo Gatti
Cos'è un carico nucleare efficace?
IL carico nucleare efficace (rappresentato come zEF E in alcuni casi come z*) È il carico nucleare netto che un elettrone sperimenta quando si trova in un atomo polielettronico (cioè ha più di un elettrone).
In un modo più preciso, è la carica elettrica che avrebbe il nucleo di un ipotetico atomo in grado di attirare il suo unico elettrone con la stessa forza con cui il nucleo del vero atomo attira lo stesso elettrone in presenza di tutti gli altri elettroni.
È un carico nucleare corretto che tiene conto dell'effetto della presenza di altri elettroni su un atomo polilettronico. Questo carico ridotto spiega perché gli elettroni più esterni in un atomo polielettronico sono deboli legati al nucleo rispetto agli elettroni interni.
Un carico nucleare efficace è un concetto di grande importanza nella chimica, poiché ci consente di comprendere la tendenza periodica di molte proprietà come il raggio atomico, il raggio ionico, l'elettronegatività, le energie di ionizzazione e altro ancora.
Perché esiste il carico nucleare efficace?
L'efficace carico nucleare deriva da due fenomeni:
- L'effetto di schermatura degli elettroni sugli atomi di polielettronici.
- Repulsione elettrostatica tra gli elettroni perché tutti hanno la stessa carica elettrica.
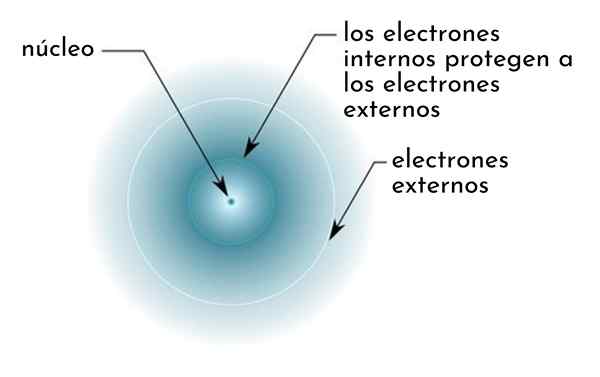
Lui Effetto di schermatura È costituito da una specie di scudo formato dagli elettroni interni di un atomo che copre il nucleo. Questo rende gli elettroni più esterni "sentirsi" un'attrazione più bassa da parte del nucleo di quanto si sentirebbero se gli altri elettroni non fossero presenti.
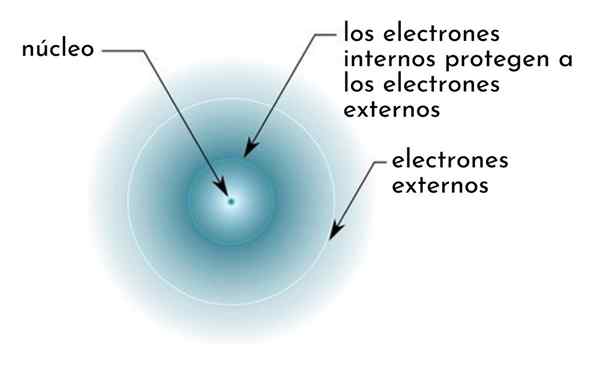 Figura che mostrano schematicamente elettroni interni che agiscono come uno schermo che protegge gli elettroni esterni dell'attrazione del nucleo
Figura che mostrano schematicamente elettroni interni che agiscono come uno schermo che protegge gli elettroni esterni dell'attrazione del nucleo Ad esempio, il carico nucleare dell'atomo di sodio è +11 (il suo numero atomico è z = 11), ma l'unico elettrone di Valencia che possiede, sente in realtà la forza di attrazione di un carico di soli +2,2.
Può servirti: benzoato di sodio: struttura, proprietà, usi e rischiIn altre parole, la schermatura degli altri 10 elettroni interni fa sì che l'elettrone di Valencia del sodio sentasse una forza di attrazione nucleare del solo quinto di quello che dovrebbe essere.
Oltre all'effetto di schermatura, il repulsione tra elettroni (che hanno la stessa carica elettrica) contribuisce anche a contrastare la capacità del nucleo di attrarre elettroni esterni. Cioè, questa repulsione aiuta anche a ridurre il carico nucleare efficace.
Caratteristiche importanti della carico nucleare efficace
Va notato che l'effetto di schermatura responsabile della riduzione del carico nucleare efficace influisce solo sugli elettroni che si trovano nello stesso livello di energia o negli strati superiori, ma non gli elettroni più interni. Inoltre, l'effetto non è lo stesso per gli elettroni trovati negli orbitali atomici S e P rispetto a quelli trovati negli orbitali D e F.
Per questo motivo, ogni set di elettroni di ciascun livello o livello di energia sente un carico nucleare efficace diverso. Ciò ha importanti implicazioni riguardo alle proprietà chimiche dei diversi elementi.
Tendenza periodica della carico nucleare efficace
Su un periodo
Gli elettroni situati allo stesso livello di energia sono meno protettivi di quelli riscontrati nei livelli di energia inferiori.
Per questo motivo, l'effetto di schermatura non aumenta considerevolmente quando ci muoviamo per un periodo, ma il vero carico nucleare lo fa. Per questo motivo, l'effettivo carico nucleare aumenti da sinistra a destra nella tabella periodica.
In un gruppo
D'altra parte, quando si passa da un periodo all'altro nello stesso gruppo (cioè quando ci muoviamo lungo un gruppo), vengono aggiunti interi strati di elettroni interni molto protettivi. Questo rende l'effettiva diminuzione del carico nucleare dall'alto verso il basso o, qual è lo stesso, aumentare dal basso verso l'alto.
Può servirti: ayaroínaFormula efficace di carico nucleare
Un carico nucleare efficace può essere calcolato mediante un'equazione semi -tempo molto semplice che tiene conto del valore effettivo del carico nucleare (dato dal numero atomico, z) e un termine chiamato schermatura costante. Quest'ultimo comprende gli effetti della presenza di altri elettroni in uno.
L'equazione è data da:
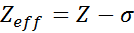
dove z è il numero atomico e σ (lettera greca sigma) rappresenta la costante di schermatura, che dipende dalla configurazione elettronica.
Regole di slater
La costante di schermatura può essere stimata da un sistema noto come Slater Rules. Queste regole consentono di calcolare la costante di scudo di un elettrone aggiungendo i contributi degli altri elettroni a detta costante di schermatura. Queste regole possono essere riassunte come segue:
- Qualsiasi elettrone che è allo stesso livello di energia (livello N0) Fornisce una quantità di 0,35 alla costante di schermatura, a meno che entrambi non siano al livello 1, nel qual caso fornisce 0,30.
- Ogni elettrone che si trova al livello immediatamente precedente (a livello N0-1) in un orbitale s o p, porta 0,85; D'altra parte, se si trova in un orbitale d o f contribuisce 1.
- Tutti gli altri elettroni che sono a livelli di energia più bassi (n0-2, n0-3, ecc.), contribuire 1 alla costante di schermatura.
Esempio di efficace calcolo del carico nucleare
Valencia Electron of the Sodio Atom
La configurazione elettronica dell'atomo di sodio è 1s22s22 p63s1. Vale a dire che se vogliamo calcolare l'effettiva carico nucleare che si sente l'elettrone di Valencia (l'elettrone 3S1), dobbiamo aggiungere i contributi degli altri 10 elettroni seguendo le regole di Slater.
Può servirti: ossido di ferro (ii): struttura, nomenclatura, proprietà, usiCome stiamo calcolando costante lo scudo elettronico 3s1 (N0= 3) e questo è solo nello strato di Valencia, non ci sono altri elettroni allo stesso livello di energia.
Il livello immediatamente precedente è n0-1 = 2, dove ci sono 8 elettroni in orbitale s o p che contribuiscono a 0,85 ciascuno e non ci sono elettroni negli orbitali d o f.
Infine, l'unico livello inferiore a 2 è n = 1, in cui ci sono solo 2 elettroni. Tutto ciò è riassunto nella tabella seguente:
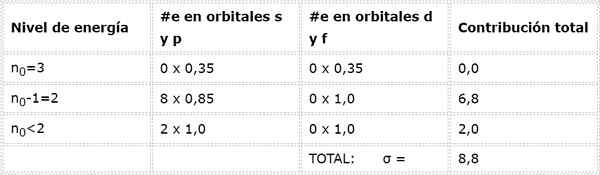
Come si può vedere, gli elettroni interni del sodio forniscono una costante di scudo di 8,8, quindi l'effettiva carico nucleare che l'elettrone sente 3s1 È:
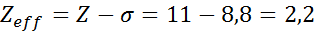
Elettroni di Arsenico Valencia
La configurazione elettronica arsenica è 1s22s22 p63s23p63d104s24p3. Lo strato di Valencia è strato 4 (n0= 4) che ha 5 elettroni: (4s24p3). In questo caso, ciascuno di questi 5 elettroni sentirà l'effetto degli altri 4 che si trovano nello stesso strato e quello degli altri 28 elettroni interni come mostrato nella tabella:
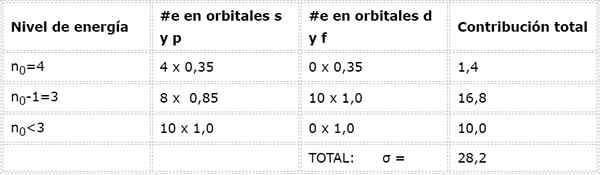
Pertanto, l'effettivo carico nucleare che sentono gli elettroni di Valencia di arsenico: