Carbonio

- 4663
- 1445
- Enzo De Angelis
Cos'è il carbonio?
Lui carbonio È un elemento chimico non metallico il cui simbolo chimico è C. Il suo nome è dovuto a carbone, verdure o minerali, dove i suoi atomi definiscono varie strutture. Forma una vasta gamma di composti organici e inorganici e si presenta anche in un numero considerevole di alotropi.
Il carbonio si trova in tutti gli esseri viventi; Tutte le sue biomolecole devono la sua esistenza alla stabilità e alla forza dei legami C-C e alla loro alta tendenza a concatenare. È l'elemento della vita e con i loro atomi sono costruiti i loro corpi.
I composti organici con cui sono costruiti i biomateriali sono costituiti da scheletri carbonizzati ed eteroatomi. Questi possono essere visti a prima vista nel bosco degli alberi; E anche, quando il fulmine cade su di loro e Rostiza. Il restante solido nero inerte ha anche carbonio; Ma è un carbone vegetale.
Proprietà del carbonio
Le proprietà fisiche o chimiche presenti in solidi, minerali o materiali carbonacei sono soggette a molte variabili. Tra questi ci sono: la composizione o il grado di impurità, le ibridazioni degli atomi di carbonio, la diversità delle strutture e la morfologia o le dimensioni dei pori.
Quando le proprietà del carbonio descrivono, la maggior parte dei testi o delle fonti bibliografici si basa su grafite e diamante.
Perché? Perché sono gli alotropi più noti per questo elemento e rappresentano solidi o materiali ad alta purezza; Cioè, non sono praticamente fatti altro che gli atomi di carbonio (sebbene con strutture diverse, come verranno spiegate nella sezione seguente).
Le proprietà del carbone vegetale e minerale differiscono rispettivamente nelle loro origini o composizioni. Ad esempio, lignite (povera carbonio) come combustibile gatea rispetto all'antracite (ricco di carbonio). E cosa dire degli altri alotropi: nanotubi, fullerenos, grafene, graphos, ecc.
Tuttavia, hanno chimicamente un punto comune: si ossidano con un eccesso di ossigeno in CO2:
C + O2 => Co2
Ora, la velocità o la temperatura che hanno bisogno di ossidarsi sono proprie per ciascuno di questi alotropi.
Grafite vs Diamond
Qui verrà anche fatto un breve commento riguardo alle diverse proprietà per questi due alotropi:
 Tabella in cui vengono confrontate alcune proprietà dei due allotrop di carbonio cristallini. Fonte: Gabriel Bolívar.
Tabella in cui vengono confrontate alcune proprietà dei due allotrop di carbonio cristallini. Fonte: Gabriel Bolívar. Struttura elettronica e configurazione
Ibridazioni
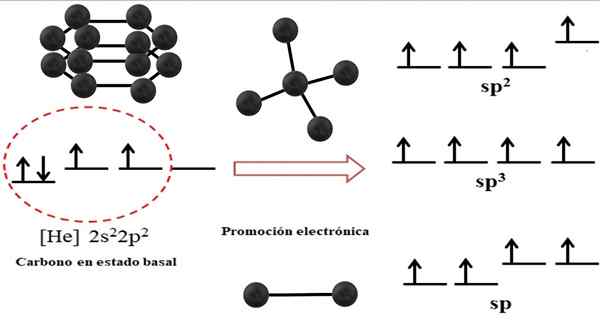 Relazione tra orbitali ibridi e possibili strutture per il carbonio. Fonte: Gabriel Bolívar.
Relazione tra orbitali ibridi e possibili strutture per il carbonio. Fonte: Gabriel Bolívar. La configurazione elettronica per l'atomo di carbonio è 1s22s22 p2, anche scritto come [lui] 2s22 p2 (Immagine superiore). Questa rappresentazione corrisponde al suo stato basale: l'atomo di carbonio isolato e sospeso in un tale vuoto che non può interagire con gli altri.
Può servirti: struttura cristallinaÈ apprezzato che uno dei suoi orbitali 2p non ha elettroni, che accetta un elettrone dell'orbitale di energia minore mediante promozione elettronica; E quindi, l'atomo acquisisce la capacità di formare fino a quattro legami covalenti attraverso i suoi quattro orbitali ibridi SP3.
Si noti che i quattro orbitali SP3 Sono degenerati in energia (allineati allo stesso livello). Gli orbitali P Pure sono più energiche, motivo per cui sono al di sopra degli altri orbitali ibridi (a destra dell'immagine).
Se ci sono tre orbitali ibridi, è perché un orbitale rimane P senza ibridazione; Pertanto, sono tre orbitali SP2. E quando ci sono due di questi orbitali ibridi, due orbitali P Sono disponibili per formare legami doppi o tripli, essendo l'ibridazione del carbonio F.
Tali aspetti elettronici sono essenziali per capire perché il carbonio può essere trovato negli infiniti di alotropi.
Numeri di ossidazione
Prima di continuare con le strutture, non è altri menzionarla, data la configurazione elettronica di Valencia 2S22 p2, Il carbonio può avere i seguenti numeri di ossidazione: +4, +2, 0, -2 e -4.
Perché? Questi numeri corrispondono al presupposto che esiste un legame ionico in modo tale da formare gli ioni con i rispettivi carichi; cioè, c4+, C2+, C0 (neutro), c2- e C4-.
Perché il carbonio abbia un numero di ossidazione positivo, deve perdere elettroni; E per farlo, deve necessariamente essere collegato ad atomi molto elettronegativi (come l'ossigeno).
Nel frattempo, affinché il carbonio abbia un numero di ossidazione negativo, deve guadagnare elettroni che si collegano a atomi di metallo o meno elettronegativi rispetto a lui (come l'idrogeno).
Il primo problema di ossidazione, +4, significa che il carbonio ha perso tutti gli elettroni di valenza; Gli orbitali 2s e 2p sono vuoti. Se l'orbitale 2p perde i suoi due elettroni, il carbonio avrà un numero di ossidazione di +2; Se vinci due elettroni, avrai -2; E se vince altri due elettroni che completano il suo ottetto da Valencia, -4.
Esempi
Ad esempio, per CO2 Il numero di ossidazione del carbonio è +4 (perché l'ossigeno è più elettronegativo); mentre per Cho4, è -4 (perché l'idrogeno è meno elettronegativo).
Può servirti: idrazina: struttura, proprietà, sintesi, usiPer ch3Oh, il numero di ossidazione del carbonio è -2 (+1 per H e -2 per O); Mentre per Hcooh, è +2 (controlla che la somma di 0).
Anche altri stati di ossidazione, come -3 e +3, sono probabili, specialmente quando si tratta di molecole organiche; Ad esempio, in gruppi metilici, -CH3.
Geometrie molecolari
Nell'immagine superiore, non solo l'ibridazione degli orbitali per l'atomo di carbonio, ma anche le geometrie molecolari risultanti quando diversi atomi (sfere neri) sono collegati a un centrale. Questo atomo centrale per smaltire un ambiente geometrico specifico nello spazio, deve possedere la rispettiva ibridazione chimica che è consentita.
Ad esempio, per il tetraedro il carbonio centrale ha ibridazione SP3; Perché tale è la disposizione più stabile per i quattro SP ibridi3. Nel caso dei carboni SP2, Possono formare doppi collegamenti e smaltire un ambiente piatto trigonale; E così, questi triangoli definiscono un esagono perfetto. E per un'ibridazione SP, i carboni adottano la geometria lineare.
Pertanto, le geometrie osservate nelle strutture di tutti gli alotropi sono semplicemente governate in tetraedri (sp3), esagoni o pentagoni (sp2) e linee (sp).
Tetrahedra definisce una struttura 3D, mentre esagoni, pentagoni e linee, strutture 3D o 2D; Quest'ultimo diventa gli aerei o fogli simili alle pareti delle api di nido d'ape:
 Muro con disegni esagonali di un nido d'ape in analogia agli aerei composti da carboni SP2. Fonte: Pixabay.
Muro con disegni esagonali di un nido d'ape in analogia agli aerei composti da carboni SP2. Fonte: Pixabay. E se pieghiamo questa parete esagonale (pentagonale o mista), otterremo un tubo (nanotubi) o una palla (fullerene) o un'altra figura. Le interazioni tra queste figure danno origine a diverse morfologie.
Solidi amorfi o cristallini
Lasciando geometrie, ibridazioni o morfologie delle possibili strutture di carbonio, i loro solidi possono classificare a livello globale in due tipi: amorfo o cristallino. E tra queste due classificazioni i loro alotropi sono distribuiti.
Il carbonio amorfo è semplicemente quello che presenta una miscela arbitraria di tetraedri, esagoni o linee, incapace di stabilire un modello strutturale; Questo è il caso di carbone, vegetale o carbone attivato, coke, fuliggine, ecc.
Mentre il carbonio cristallino è costituito da schemi strutturali formati da una qualsiasi delle geometrie sollevate; Ad esempio, Diamond (rete di tetrahedra a tre dimensioni) e grafite (fogli esagonali impilati).
Può servirti: nitrato di sodio (nano3): struttura, proprietà, usi, rischiDov'è il carbonio?
Oltre ad essere l'elemento chimico comune in tutte le forme di vita, il carbonio in natura è presente in tre forme cristalline: diamante, grafite e guida.
Esistono anche diverse forme minerali di carbone amorfo (antracite, lignite, stupido, torba), forme liquide (varietà di petrolio) e soda (gas naturale).
Applicazioni
Ancora una volta, come le proprietà e la struttura, gli usi o le applicazioni sono coerenti con gli aloghi o le forme mineralogiche di carbonio. Tuttavia, ci sono alcune generalità che possono essere menzionate, oltre ad alcuni punti altamente noti. Tali sono:
-Il carbonio è stato usato a lungo come agente a riduzione dei minerali nell'ottenimento di metalli puri; Ad esempio, ferro, silicio e fosforo, tra gli altri.
-È la pietra angolare della vita, e la chimica organica e la biochimica sono gli studi di questa riflessione.
-È stato anche un combustibile fossile che ha permesso alle prime macchine di andare alle loro marce. Allo stesso modo, il gas di carbonio per i vecchi sistemi di illuminazione è stato ottenuto da lui. Il carbone era sinonimo di luce, calore ed energia.
-Mescolato come additivo con ferro in diverse proporzioni ha permesso l'invenzione e il miglioramento degli acciai.
-Il suo colore nero ebbe luogo nell'arte, in particolare la grafite e tutti gli scritti realizzati con i loro colpi.
Rischi e precauzioni
Il carbonio e i suoi solidi non rappresentano alcun rischio per la salute. Che si è preoccupato per una borsa a carbone? Li vendono a molti nelle sale di alcuni mercati e fintanto che non c'è fuoco vicino, i loro blocchi neri non bruceranno.
La coca, d'altra parte, può rappresentare un rischio se il suo contenuto di zolfo è alto. Quando la combustione rilascerà gas di zolfo che, oltre ad essere tossici, contribuiscono alla pioggia acida. E sebbene il CO2 In piccole quantità non può soffocarci, ha un impatto enorme sull'ambiente come gas serra.
Da questa prospettiva, il carbonio è un pericolo "a lungo termine", poiché la sua combustione altera il clima del nostro pianeta.
E in un senso più fisico, i solidi o i materiali carbonacei se vengono spruzzati vengono facilmente trasportati dalle correnti d'aria; E di conseguenza, vengono introdotti direttamente ai polmoni, il che può danneggiarli in modo irremediale.
Del resto, è molto comune consumare "carbone" quando un po 'di cibo sta cucinando.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- « Caratteristiche lagomorfi, cibo, riproduzione, habitat
- Cos'è ciò che è, nella mitosi, nella meiosi »

