Bicarbonato di calcio

- 1160
- 78
- Lino Lombardi
 Il bicarbonato di calcio è un sale inorganico del gruppo bicarbonato
Il bicarbonato di calcio è un sale inorganico del gruppo bicarbonato Cos'è il bicarbonato di calcio?
Lui bicarbonato di calcio È un sale inorganico con formula chimica CA (HCO3)2. Origina la natura dal carbonato di calcio presente in calcare e pietre minerali come la calcite.
Il bicarbonato di calcio è più solubile in acqua rispetto al carbonato di calcio. Questa funzione ha permesso la formazione di sistemi carsici nelle rocce calcaree e nella strutturazione delle grotte.
Le acque sotterranee che attraversano le fessure sono sature nello spostamento dell'anidride carbonica (CO2).
Queste acque erode rocce calcaree che rilasciano carbonato di calcio (Caco3) che si formerà il bicarbonato di calcio, secondo la seguente reazione:
Ladro3(s) +co2(g) +H2O (l) => ca (HCO3)2(AQ)
Questa reazione si verifica nelle grotte dove hanno origine acque molto dure. Il bicarbonato di calcio non è allo stato solido ma in una soluzione acquosa, insieme alla CA2+, Bicarbonato (HCO3-) e lo ione carbonato (CO32-).
Successivamente, diminuendo la saturazione di anidride carbonica nell'acqua, si verifica la reazione inversa, cioè la trasformazione del bicarbonato di calcio in carbonato di calcio:
CA (HCO3)2(aq) => co2 (g) +H2O (l) +caco3 (S)
Il carbonato di calcio è poco solubile nell'acqua, questo fa sì che le sue precipitazioni si verifichino come un solido. La reazione precedente è molto importante nella formazione di stalattiti, stalagmiti e altro spessore nelle grotte.
Queste strutture rocciose sono formate dalle gocce d'acqua che cadono dal soffitto delle grotte. Il caco3 presente nelle gocce d'acqua è cristallizzato per formare le strutture sopra menzionate.
Il fatto di non trovare il bicarbonato di calcio in stato solido ha ostacolato il suo uso, trovando pochi esempi a questo proposito.
Struttura del bicarbonato di calcio
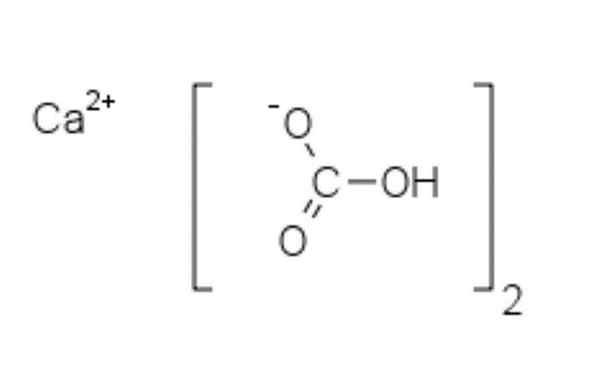 Struttura chimica del bicarbonato di calcio
Struttura chimica del bicarbonato di calcio Nell'immagine superiore sono mostrati due anioni HCO3- e una cazione2+ interagendo elettrostaticamente. Il CA2+, Secondo l'immagine, dovrebbe trovarsi nel mezzo, poiché così HCO3- Non si respingono l'uno con l'altro per le loro cariche negative.
Il carico negativo nell'HCO3- Si trasferisce tra due atomi di ossigeno, per risonanza tra il gruppo carbonile C = O e il collegamento C-O-; mentre in co32-, Questo viene trasferito tra i tre atomi di ossigeno, poiché il legame C-O non è protetto e può ricevere un carico di risonanza negativa.
Può servirti: difenilamminaLe geometrie di questi ioni possono essere considerate come sfere di calcio circondate da triangoli a carbonato piatto con un'estremità idrogenata. In termini di rapporto di dimensioni, il calcio è notevolmente più piccolo degli ioni HCO3-.
Soluzione acquosa
Bicarbonato di calcio Non puoi formare solidi cristallini ed è davvero costituito da soluzioni acquose di questo sale. In essi, gli ioni non sono soli, come nell'immagine, ma circondati da molecole H2O.
Ogni ione è circondato da una sfera di idratazione, che dipenderà dal metallo, dalla polarità e dalla struttura delle specie disciolte.
Il CA2+ Si coordina con gli atomi di ossigeno dell'acqua per formare un Aquocomplex, CA (OH2)N2+, dove n di solito è considerato sei; Cioè, un "ottaedro acquoso" attorno al calcio.
Mentre gli anioni HCO3- Interagiscono bene, o con ponti idrogeno (o2Co-h-oh2) o con gli atomi di idrogeno dell'acqua nella direzione del carico negativo (hoco2- H-OH, interazione dipolo).
Queste interazioni tra il CA2+, HCO3- E l'acqua è così efficiente, che rendono il bicarbonato di calcio molto solubile in quel solvente; A differenza del carbonato di calcio (Caco3), in cui le attrazioni elettrostatiche tra la CA2+ e il co32- Sono molto forti, precipitando la soluzione acquosa.
Oltre all'acqua, ci sono colecole2 Intorno, che reagiscono lentamente per contribuire con più HCO3- (A seconda dei valori di pH).
Ipotetico solido
Finora, dimensioni e carichi di ioni nel bicarbonato di calcio, né nella presenza di acqua, spiegano perché non esiste un composto solido; Cioè, cristalli puri che possono essere caratterizzati dalla cristallografia a raggi X. Il bicarbonato di calcio non è altro che gli ioni presenti nell'acqua da cui le formazioni cavernose continuano a crescere.
Sì CA2+ e l'HCO3- Potrebbero isolarsi dall'acqua evitando la seguente reazione chimica:
CA (HCO3)2(AQ) → Caco3(s) + co2(g) + H2O (l)
Quindi questi potrebbero essere raggruppati in un solido cristallino bianco con proporzioni stechiometriche 2: 1 (2HCO3/1CA).
Può servirti: 30 esempi di sospensioni chimicheNon ci sono studi sulla sua struttura, ma potrebbe essere confrontato con quello del bicarbonato di sodio (come bicarbonato di magnesio, MG (HCO3)2, Né esiste come solido) o con quello del carbonato di calcio.
Stabilità: bicarbonato di sodio (Nahco3) vs. Bicarbonato di calcio (CA (HCO3)2)
Il bicarbonato di sodio si cristallizza nel sistema monoclinico e nel bicarbonato di calcio nei sistemi trigonali (calcite) e ortorrombici (Aragonite).
Se il NA deve essere sostituito+ per il CA2+, La rete cristallina sarebbe destabilizzata dalla maggiore differenza di dimensioni; cioè il na+ Per essere più piccoli, forma un vetro più stabile con l'HCO3- Rispetto alla CA2+.
In effetti, la CA (HCO3)2(aq) ha bisogno di acqua per evaporare in modo che i suoi ioni possano essere raggruppati in un vetro; Ma la rete cristallina di questo non è abbastanza forte da farlo a temperatura ambiente. Quando si riscuote l'acqua, si verifica la reazione di decomposizione (equazione dall'alto).
Essere lo ione na+ In soluzione, questo costituirebbe il vetro con l'HCO3- Prima della sua decomposizione termica.
Il motivo per cui quindi il bicarbonato di calcio non si cristallizza (teoricamente), è a causa della differenza di radio ioniche o dimensioni dei loro ioni, che non può formare un cristallo stabile prima della loro decomposizione.
Bicarbonato di calcio (CA (HCO3)2) vs. carbonato di calcio (Caco3)
Se d'altra parte, viene aggiunto h+ Alle strutture cristalline del carbonato di calcio, cambierebbero drasticamente le loro proprietà fisiche. Forse, i loro punti di fusione cadono in modo significativo e persino le morfologie dei cristalli sono modificate.
Proprietà fisiche e chimiche
Formula chimica
CA (HCO3)2
Peso molecolare
162.11 g/mol
Stato fisico
Non appare in stato solido. Si trova in soluzione acquosa e quando viene applicato il calore per evaporare, diventa carbonato di calcio.
Solubilità dell'acqua
16,1 g/100 ml a 0º C; 16,6 g/100 ml a 20º C e 18,4 g/100 ml a 100º C.
Questi valori sono indicativi di una grande affinità delle molecole d'acqua da parte degli ioni del bicarbonato di calcio, come spiegato nella sezione precedente. Nel frattempo, solo 15 mg di carbonato di calcio si dissolvono in un litro d'acqua, che riflette le sue forti interazioni elettrostatiche.
Perché bicarbonato di calcio non può formare un solido, la sua solubilità non può essere determinata sperimentalmente.
Tuttavia, date le condizioni create dal CO2 Dissoltato nell'acqua che circonda il calcare, la massa di calcio disciolta a una temperatura t potrebbe essere calcolata; massa che sarebbe uguale alla concentrazione di bicarbonato di calcio.
Può servirti: acido benzyico: sintesi, trasposizione e usiA temperature diverse, la massa disciolta aumenta, come mostrato nei valori a 0, 20 e 100º C. Quindi, secondo questi esperimenti, è determinato la quantità di bicarbonato di calcio Si dissolve in prossimità del carbonato di calcio, in un mezzo acquoso gassificato con CO2.
Una volta che il CO fugge2 Gassoso, il carbonato di calcio precipiterà, ma non il bicarbonato di calcio.
Fusion e bollitura
La rete cristallina della CA (HCO3)2 È molto più debole di quello del caco3. Se potesse essere ottenuto in uno stato solido e misurare la temperatura alla quale si scioglie all'interno di una fonte, sicuramente un valore sarebbe ottenuto ben al di sotto di 899º. Allo stesso modo, lo stesso dovrebbe essere previsto per determinare il punto di ebollizione.
Punto di combustione
Non è carburante.
Rischi
Poiché questo composto non esiste solidamente, è improbabile che rappresenti un rischio di manipolare le sue soluzioni acquose, poiché entrambi gli ioni CA2+ Come HCO3- Non sono dannosi a basse concentrazioni; E quindi, il rischio maggiore, che sarebbe quello di ingerire tali soluzioni, potrebbe essere dovuto solo a una pericolosa dose di calcio ingerito.
Se il composto formava un solido, anche forse fisicamente diverso dal caco3, I suoi effetti tossici non potevano andare oltre il semplice disagio e resezione dopo il contatto fisico o l'inalazione.
Applicazioni
- Le soluzioni di bicarbonato di calcio sono state utilizzate a lungo per lavare le carte antiche, in particolare le opere d'arte o documenti storicamente importanti.
- Le soluzioni di bicarbonato sono state utilizzate nella prevenzione dell'osteoporosi. Tuttavia, in un caso, sono stati osservati effetti collaterali come ipercalcemia, alcalosi metabolica e insufficienza renale.
- Il bicarbonato di calcio viene somministrato, occasionalmente, per via endovenosa per correggere l'effetto depressivo dell'iproymia sul funzionamento cardiaco.
- È usato per calmare l'acidità dello stomaco.
Riferimenti
- Wikipedia (2018). Bicarbonato di calcio. Preso da: in.Wikipedia.org
- Sirah Dubois (3 ottobre 2017). Cos'è il bicarbonato di calcio? Recuperato da: Livestrong.com
- Science Learning Hub (2018). Chimica del carbonato. Recuperato da: Scuelelarn.org.NZ
- PUBCHEM (2018). Bicarbonato di calcio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov

