Blu bromotimolo

- 3839
- 1120
- Dott. Rodolfo Gatti
 Il blu bromotimolo è un indicatore di pH. Fonte: Wikimedia Commons
Il blu bromotimolo è un indicatore di pH. Fonte: Wikimedia Commons Cos'è blu bromotimol?
Lui Blu bromotimolo È un derivato di trifenilmetano che funge da indicatore di pH. Un indicatore è una tintura organica il cui colore dipende dalla concentrazione dello ione h3O+ o del pH medio. A causa del colore che mostra, l'indicatore può indicare l'acidità o l'alcalinità della soluzione.
Il blu bromotimolo ha una scala di indicazione attiva tra un pH 6.0 e 7.6. A un pH del mezzo inferiore a 6.5 (acido) manifesta una colorazione gialla. Quando il pH medio varia tra 6.5 e 7.6 (neutro), acquisisce una colorazione verde. Un pH maggiore di 7.6 Il suo colore è blu (base).
Questa caratteristica gli dà una grande utilità, poiché può essere utilizzata su una scala di pH vicino alla neutralità, proprio dove si verificano processi fisiologici.
La ionizzazione blu di bromotimolo in soluzione acquosa può essere schematizzata come segue:
Hin (giallo) +h₂o in- (colore blu) + H3O+
Quando l'indicatore è protonato (Hin) acquisisce una colorazione gialla; Mentre l'indicatore non è protetto (in-) La colorazione è blu.
Struttura chimica
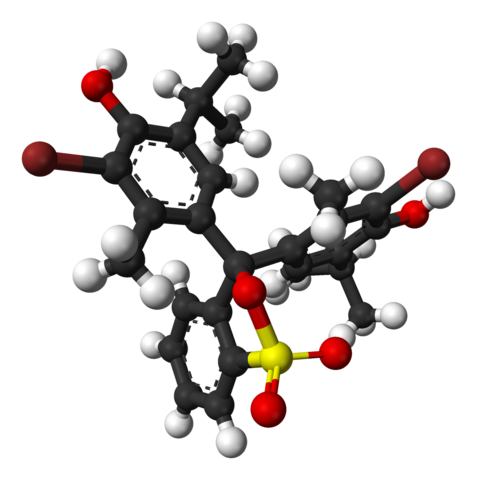 Struttura chimica del blu bromotimico. Fonte: Wikimedia Commons
Struttura chimica del blu bromotimico. Fonte: Wikimedia Commons Nell'immagine superiore, la struttura del blu bromotimolo è rappresentata con un modello a barre e sfere a un pH inferiore a 7.1. Le barre marroni corrispondono agli atomi di bromo, due in totale.
Ognuno dei tre anelli aromatici compone, accanto ai gruppi metilici, CH3, E Thermal, il gruppo Timol, e avendo collegato un BR, da lì il motivo si chiama "Bromotimol".
Può servirti: idrossidiNella parte inferiore viene mostrato il gruppo solfonato, r-so3-, Con sfere rosse e un giallo. Questo gruppo può essere collegato attraverso un atomo o un carbonio centrale che unisce i tre anelli aromatici.
PH Cambiamenti
Questa struttura molecolare, sebbene non cambia radicalmente con il pH acido o di base, altera i suoi stati elettronici, riflessa dai cambiamenti di colore delle soluzioni.
Sotto pH 7, l'indicatore è giallo e adotta la struttura dell'immagine, ma se il pH diventa base, i gruppi -oh sono sfortunati e si può formare un doppio legame c = o.
Di conseguenza, il sistema coniugato della molecola (quello di tutti i suoi doppi legami risonanti) cambia abbastanza in modo che gli elettroni non assorbano più gli stessi fotoni e la soluzione diventa dal giallo a bluastro.
Se, d'altra parte, il pH è ben al di sotto di 7, il colore dell'indicatore cambia da giallo a rosso. Qui il cambiamento nel sistema coniugato è dovuto alla protonazione dei gruppi -oh a -oh2+. -
Sia in mezzo acido che base, la molecola perde stabilità, assorbendo fotoni più piccoli per consentire transizioni elettroniche responsabili dei colori percepiti dagli spettatori.
Il colore verde osservato nell'immagine principale è dovuto a quanto segue: quando il pH a 7 si avvicina.1, una piccola porzione di molecole perde protoni, dicendo addio a un colore blu che, mescolando con il giallo, dà il colore verde.
Proprietà dBlu bromootimol
Nome chimico
Blu bromotimolo o 3,3'-dibromotimolsulfonafet.
Formula molecolare
C27H28Br2O5S.
Peso molecolare
624.384 g/mol.
Aspetto fisico
Polvere di colore solido che va tra rosa e viola.
Può servirti: bulanal: struttura, proprietà, usi e rischiCaratteristica chimica
Funge da acido debole in soluzione. Quando è protonato in un mezzo acido, acquisisce un colore giallo, un pH neutro è verde e quando è spiacevole in un pH alcalino è blu.
Costante di dissociazione ionica (KA)
7.9 x 10-8.
Intervallo di indicazione attiva
Ph 6.Da 0 a 7.6. Ciò è dovuto alla presenza di atomi di bromo che agiscono estraendo elettroni e due gruppi di donatori di elettroni moderati (sostituenti alchilici).
Densità
1.25 g/cm3.
Punto di fusione
202 ° C (396 ° F).
Punto di ebollizione
184.9 ° C.
Solubilità
È appena solubile in acqua e olio. È anche poco solubile in solventi non polari come benzene, toluene e xilene e praticamente insolubile nell'etere dell'olio. È solubile in soluzioni acquose di alcali e alcol.
Stabilità
È stabile a temperatura ambiente e incompatibile con forti agenti ossidanti.
Assorbimento della luce
La forma protonata ha il suo massimo assorbimento a una lunghezza d'onda (λ) di 427 nm, trasmettendo così la luce gialla in soluzioni acide e la forma non protetta ha un assorbimento massimo a una lunghezza d'onda (λ) di 602 nm, trasmettendo una luce una luce blu a alcalino pH.
Usi e applicazioni
Negli studi metabolici
Il blu bromotimolo viene utilizzato in numerosi processi in cui viene prodotto l'anidride carbonica (CO₂), con la conseguente generazione di acido carbonico (H2Co3), che acidifica il mezzo, che è evidenziato da un cambiamento nella colorazione del blu bromotimico.
Se una persona sta eseguendo un esercizio fisico ed è collegata a un tubo che, a sua volta, è in relazione a un contenitore con una soluzione di blu bromotimico, verrà osservato il seguente fenomeno: come conseguenza dell'aumento dell'attività fisica e Metabolismo, si verificherà un aumento della produzione di co₂.
Può servirti: silicio: storia, proprietà, struttura, ottenimento, usiIl CO₂ reagirà con l'acqua, producendo acido carbonico, h2Co3, che in seguito dissocia il rilascio dello ione h+ e acidificare il mezzo. Ciò si traduce in blu di bromotimol acquisisce una colorazione gialla, evidenziando l'acidità dell'ambiente.
In ostetricia
Il blu bromotimolo è usato in ostetricia per mostrare una rottura precoce delle membrane. Il fluido amniotico normalmente ha un pH maggiore di 7.7, quindi il blu bromotimico coloro il blu, quando si mette in contatto con il liquido che sfugge all'amnio.
Il pH vaginale è generalmente acido, quindi il blu bromotimolo ha una colorazione gialla. Il cambiamento del suo colore in blu manifesta la presenza di liquido amniotico nella regione vaginale.
Altri usi
Blu blu bromotimol ha anche l'applicazione nelle seguenti attrezzature e funzioni:
- Sensori ottici
- Sistemi di rilevamento della combustione di gas
- Nell'elaborazione di dipinti, giocattoli, prodotti per la pulizia, detergenti e tessuti
- Sensori di freschezza alimentare
- Come identificatore di riso fresco e rancido
- Nella rilevazione di microrganismi.
È anche usato nell'analisi della crescita batterica, nei farmaci psicoattivi e nei materiali dentali.
Preparazione
100 mg di blu di bromotimolo vengono sciolti in 100 ml di alcol diluito e, se necessario, filtrano. Viene anche preparato come segue: 50 mg di blu bromotimolo vengono sciolti in una miscela di 4 ml di idrossido di sodio 0,02 N e 20 ml di alcool, completando 100 ml con acqua.
Riferimenti
- Foist l. Blu bromothymol: definizione, usi e formula. Studio recuperato.com
- Indicatore di pH blu bromothymolo, 1 oz. Recuperato da ScienceCompany.com
- Determinazione spettrofotometrica di PK dell'indicatore blu bromotimolo. Recuperato da FCH.UPOL.cz

