Struttura primaria alcol, proprietà, nomenclatura, esempi

- 2865
- 610
- Rufo Longo
UN Alcol primario È quello in cui il gruppo idrossilico è collegato a un carbonio primario; Questo è, un carbonio attaccato covalentemente a un altro carbonio e idrogeni. La sua formula generale è ROH, in particolare RCH2Oh, dal momento che c'è solo un gruppo di noleggio r.
Il gruppo RCH Formula R2Oh può essere chiunque: una catena, un anello o eteroatomi. Quando si tratta di una catena, corta o lunga, è prima degli alcoli primari più rappresentativi; Tra questi ci sono metanolo ed etanolo, due dei più sintetizzati a livello industriale.
 Jart di birra: un esempio di una soluzione acquosa di alcol etilico, un alcol primario, in una matrice biologica. Fonte: Engin Akyurt tramite Pexels.
Jart di birra: un esempio di una soluzione acquosa di alcol etilico, un alcol primario, in una matrice biologica. Fonte: Engin Akyurt tramite Pexels. Fisicamente sono come altri alcoli e i loro punti di ebollizione o fusione dipendono dal grado delle loro ramificazioni; Ma chimicamente, sono i più reattivi. Inoltre, la sua acidità è superiore a quella degli alcoli secondari e terziari.
Gli alcoli primari sperimentano reazioni di ossidazione, diventando un ampio numero di composti organici: esteri ed eteri, aldeidi e acidi carbossilici. Possono anche subire reazioni di disidratazione, diventando alcheni o olefine.
[TOC]
Struttura di un alcol primario
Gli alcoli primari derivati da alcani lineari sono i più rappresentativi. Tuttavia, in realtà qualsiasi struttura, lineare o ramificata, può essere classificata all'interno di questo tipo di alcoli purché il gruppo OH sia collegato a un CH2.
Quindi, strutturalmente tutti hanno in comune la presenza del gruppo -CH2Oh, chiamato metilolo. Una caratteristica e una conseguenza di questo fatto è che il gruppo OH è meno prevenuto; cioè, può interagire con l'ambiente senza altri atomi che ostacolano spazialmente.
Inoltre, un oh meno prevenuto significa che l'atomo di carbonio che lo porta, la scelta2, può subire reazioni di sostituzione attraverso un meccanismo SN2 (bimolecolare, senza la formazione di un carbocalizzazione).
D'altra parte, un OH con maggiore libertà di interagire con l'ambiente, si traduce come interazioni intermolecolari più forti (da ponti idrogeno), che a sua volta aumenta la fusione o i punti di ebollizione.
Può servirti: idrossido di nichel (III): struttura, proprietà, usi, rischiSuccede anche con la sua solubilità nei solventi polari, purché il gruppo R non sia molto idrofobo.
Proprietà
Acidità
Gli alcoli primari provengono da tutti i più acidi. Affinché un alcol si comporti come un acido brnsted, uno ione H deve donare+ nel mezzo, per dire acqua, per diventare un anione alcossido:
Roh + h2ORO- + H3O+
Il carico negativo del rosso-, in particolare dell'RCH2O-, Senti meno repulsione da parte degli elettroni dei due legami C-H, che dagli elettroni del legame C-R.
Il gruppo di noleggio esercita quindi la più grande repulsione, destabilizzante RCH2O-; Ma non tanto rispetto al fatto che se ci sono due o tre gruppi R, come nel caso degli alcoli secondari e terziari, rispettivamente.
Un altro modo per spiegare la massima acidità di un alcol primario è attraverso la differenza di elettronegatività, creando il momento dipolo: H2CΔ+-OΔ-H. L'ossigeno attira la densità elettronica entrambi di CH2 A partire da H; Il carico parziale positivo di carbonio respinge un po 'di idrogeno.
Il gruppo R trasferisce un po 'della sua densità elettronica a Cho2, che aiuta a ridurre il suo carico parziale positivo e con esso la sua repulsione per il carico di idrogeno. Più gruppi RA, più bassa è la repulsione, e quindi, la tendenza di H deve essere rilasciata come h+.
PKA
Gli alcoli primari sono considerati acidi più deboli rispetto all'acqua, ad eccezione dell'alcool metilico, che è leggermente più forte. Il PKA di alcol metilico è 15,2; E il PKA dell'alcool etilico è 16.0. Nel frattempo, l'acqua PKA è 15,7.
Tuttavia, l'acqua che è considerata un acido debole, come gli alcoli, può unirsi a H+ Trasformarsi nello ione idiota, h3O+; cioè, si comporta come una base.
Allo stesso modo, gli alcoli primari possono catturare l'idrogeno; Soprattutto in alcune delle reazioni che sono le sue, ad esempio, nella loro trasformazione in alcheni o olefini.
Reazioni chimiche
Affittare la formazione di Halogenuros
Gli alcoli reagiscono con alogenidi idrogeno per produrre alogenidi alchilici. La reattività degli alcoli di fronte agli alogenidi di idrogeno, scende nel seguente ordine:
Può servirti: carbonioAlcool terziario> Alcol secondario> Alcol primario
Roh +hx => rx +h2O
Rx è un alogenuro alchilico primario (scegli3Cl, Ch3Cap2BR, ecc.).
Un altro modo per preparare alogenuro alchilico è attraverso la reazione del cloruro di tionilo, un reagente sintetico, con un alcool primario che diventa un cloruro alchilico. Cloruro di tionilo (SOCL2) richiede di reagire la presenza di piridina.
Cap3(Ch2)3Cap2Oh +Socl2 => Ch3(Ch2)3Cap2Cl +SO2 + HCl
Questa reazione corrisponde all'alogenazione di 1-penolo per diventare 1-cloropentano in presenza di piridina.
Ossidazione degli alcoli primari
Gli alcoli possono essere ossidati in aldeidi e acidi carbossilici, a seconda del reagente. Il clorocromato di piridinio (PCC) ossida l'alcol primario in aldeide, usando il diclorometano come solvente (CH2Cl2)
Cap3(Ch2)5Cap2Oh => Cho3(Ch2)5COH
Questa è l'ossidazione di 1-eptanolo in 1-eptanal.
Nel frattempo, permanganato di potassio (kmno4) Alcool prima alcol e poi ossidato nell'aldeide all'acido carbossilico. Quando il permanganato di potassio viene utilizzato per ossidare gli alcoli, la rottura del legame tra i carboni 3 e 4 dovrebbe essere evitata.
Cap3(Ch2)4Cap2Oh => Cho3(Ch2)4COOH
Questa è l'ossidazione da 1-esanolo all'acido esanoico.
Con questo metodo è difficile ottenere un aldeide, poiché ossida facilmente un acido carbossilico. Una situazione simile si osserva quando l'acido cromico viene utilizzato per ossidare gli alcoli.
Formazione di E Éteres
Gli alcoli primari possono diventare eteri quando riscaldati in presenza di un catalizzatore, di solito acido solforico:
2 rch2Oh => rch2Och2R +H2O
Formazione di esare organici
La condensazione di un alcol e un acido carbossilico, esterificazione Fisher, catalizzata da un acido, produce un estere e un acqua:
Può servirti: carbocalizzazione: formazione, caratteristiche, tipi, stabilitàR'oh +rcooh rcoor ' +h2O
Una reazione ben nota è quella dell'etanolo con acido acetico, per dare acetato di etil:
Cap3Cap2Oh +ch3COOH CH3Coohch2Cap3 + H2O
L'alcool primario è il più suscettibile alle reazioni di sterilazione di Fischer.
Disidratazione
A temperature elevate e in un mezzo acido, di solito acido solforico, gli alcoli si disidratano per causare alcheni con la perdita di una molecola d'acqua.
Cap3Cap2Oh => h2C = ch2 + H2O
Questa è la reazione di disidratazione dell'etanolo all'etilene. Una formula generale più appropriata per questo tipo di reazione, in particolare per un alcol primario, sarebbe:
Rch2Oh => r = cho2 (Ciò che è anche uguale a RC = CH2)
Nomenclatura
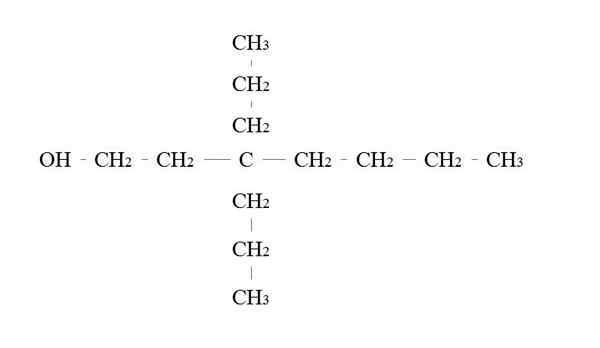 Esempio di alcol primario. Fonte: Gabriel Bolívar.
Esempio di alcol primario. Fonte: Gabriel Bolívar. Le regole per nominare un alcol primario sono le stesse degli altri alcoli; Con l'eccezione, che a volte non è necessario elencare il vettore dell'OH.
Nell'immagine superiore c'è una catena principale a sette carbonio. Il carbonio collegato all'OH viene assegnato il numero di 1, quindi inizia a contare da sinistra a destra. Il suo nome IUPAC è quindi: 3.3-dietilheptanolo.
Si noti che questo è un esempio di alcol primario altamente ramificato.
Esempi
Infine, alcuni alcoli primari sono menzionati in base alla loro nomenclatura tradizionale e sistematica:
-Metil, ch3OH
-Ethyl, ch3Cap2OH
-N-propil, ch3Cap2Cap2OH
-N-esil, cap3Cap2Cap2Cap2Cap2Cap2OH
Questi sono derivati da alcani lineari. Altri esempi sono:
-2-Feniletanolo, c6H5Cap2Cap2Oh (c6H5 = anello di benzene)
-2-Propen-1-Oc (alcool allitico), Cho2= Chch2OH
-1,2-taodiolo, ch2Ohch2OH
-2-cloroetanolo (etilecloridrina), CLCH2Cap2OH
-2-buten-1-ol (alcol crotilico), CH3Ch = chch2OH
Riferimenti
- Morrison, r.T. E boyd, r. N. (1987). Chimica organica. (5ta Edizione). Addison-Wesley Iberoamericana
- Carey, f. A. (2008). Chimica organica. (6ta Edizione). McGraw-Hill, Intermerica, Editor S.A.
- Mel Science. (2019). Come avviene l'ossidazione degli alcoli primari. Recuperato da: Melscience.com
- Royal Society of Chemistry. (2019). Definizione: alcoli primari. Recuperato da: RSC.org
- Chriss e. McDonald. (2000). L'ossidazione degli alcoli primari agli esteri: tre esperimenti investigativi correlati. J. Chimica. Educ., 2000, 77 (6), p 750. Doi: 10.1021/ED077P750
- « Caratteristiche dell'actina, struttura, filamenti, funzione
- Materiali di diamagnetismo, applicazioni, esempi »

