Struttura di alcol etilico, proprietà, usi, ottenendo
- 2125
- 189
- Cosetta Messina
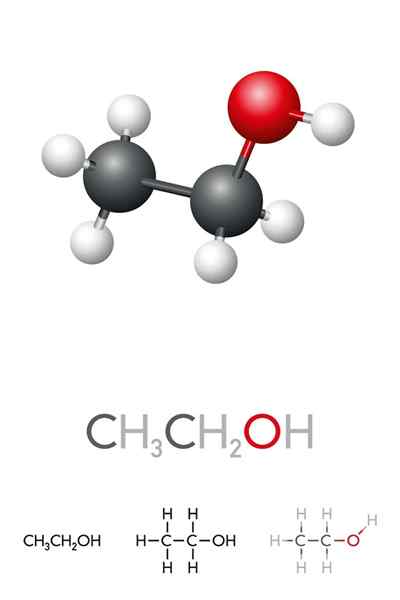
Lui Alcol etilico o etanolo È un composto organico la cui formula è c2H5Oh o ch3Cap2Oh, presentarsi come un liquido incolore. Questo è il secondo alcol primario più semplice di tutti dopo il metanolo. È molto solubile in acqua e in molti solventi organici, il che ha permesso lo sviluppo di molte delle sue applicazioni.
Questo alcol è stato usato come antisettico e disinfettante, oltre al suo uso nella sintesi di medicinali e altri prodotti chimici organici. È stato anche usato come combustibile in riscaldatore, lampade e in combinazione con benzina nei veicoli a motore.

La fermentazione dello zucchero per la produzione di etanolo è una delle prime reazioni chimiche che l'uomo primitivo ha imparato. Una ceramica di 9000 anni è stata trovata in Cina.
Ma la fermentazione degli zuccheri ha prodotto solo una soluzione di etanolo a bassa concentrazione, motivo per cui era necessario imparare le tecniche di distillazione per eliminare l'acqua e concentrare l'alcol. Così, gli alchimisti greci che lavoravano ad Alessandria nel 1 ° secolo.C., Sapevano già e usavano la distillazione.
Tuttavia, esistono percorsi sintetici che consentono di ottenere etanolo totalmente puro basato sull'etilene, che viene distillato dall'olio. Pertanto, il petrolio è una fonte indiretta di etanolo. In questo modo si ottiene l'etanolo o l'alcol assoluto.
[TOC]
Struttura di alcol etilico
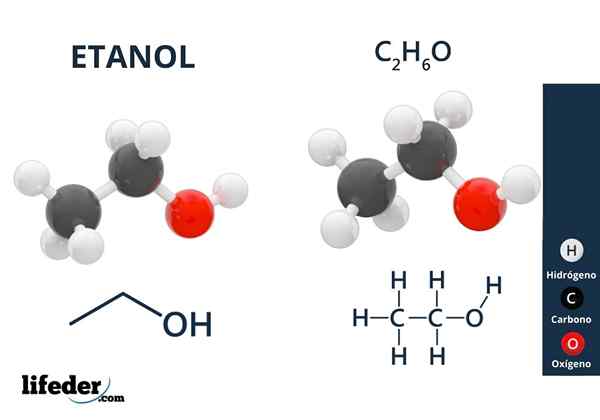
Nell'immagine superiore abbiamo la struttura molecolare dell'etanolo, Cho3-Cap2-Oh, rappresentato da un modello di spazio completo. È una molecolare piuttosto polare, poiché il gruppo OH attira la densità elettronica verso se stesso dello scheletro di carbonio a cui è collegato.
Di conseguenza, le molecole di alcol etilico interagiscono attraverso il dipolo-dipolo3Cap2Oh-ohch2Cap3. Ecco perché questo alcol ha un punto di ebollizione elevato rispetto ad altri solventi organici o liquidi.
Proprietà
Aspetto fisico
Liquido incolore.
Massa molare
46.069 g/mol
Odore
Odore morbido e simile al vino.
Gusto
Bruciare.
Densità
0.789 g/cm3 a 20 ºC
Punto di fusione
- 114.14 ºC
Punto di ebollizione
78,24 ºC
Solubilità dell'acqua
1 · 106 mg/l. Cioè, è praticamente miscibile in tutte le proporzioni.
Malibilità con solventi organici
L'etanolo è miscibile con acido acetico, acetone, benzene, tetracloruro di carbonio, cloroformio, dietetico etere, glicole etilenico, glicolo, piridina e toluene. È anche miscibile con idrocarburi alifatici leggeri, come Pentano ed Hexano.
Coefficiente di partizione ottanolo/acqua
Log p = - 0.31
Pressione del vapore
59.3 mm Hg a 25 ºC. Pertanto, ha respinto un importo percepibile di vapori.
Può servirti: cloruro di bario (bacl2)Densità del vapore
1.59 nella relazione aerea presa come unità (1)
punto di accensione
13 ºC
Temperatura di autorezione
363 ºC
Calore a combustione
1336.8 kJ/mol A 25 ºC
Combustione
L'etanolo è un liquido volatile che brucia con una fiamma blu, senza fumo, e che è praticamente invisibile alla luce naturale.
Calore specifico
0.618 calce/g a 23 ° C
Sostanza vischiosa
1.2 mpa · s a 20 ºC
Indice di rifrazione ηd
1.3611
Usi di alcol etilico
 Uno degli usi più comuni dell'alcol è come antisettico
Uno degli usi più comuni dell'alcol è come antisettico Usi medici
Antisettico
L'etanolo è usato come antisettico, poiché ha un'azione letale contro batteri e funghi. È in grado di alterare la struttura delle sue membrane plasmatiche, che produce la sua distruzione attraverso i flussi di acqua osmotica che sono stabiliti.
Allo stesso modo, l'etanolo può distruggere molti tipi di virus. Al momento si raccomanda l'uso di gel che contengono alcol per disinfettare le mani e ridurre il contagio con il coronavirus. L'etanolo è anche usato nella disinfezione di ferite minori superficiali.
Solvente di droga
Molti farmaci sono poco solubili in acqua, usando l'etanolo per aumentare la loro solubilità. Alcuni capezzoli per risciacquo per tosse e bocca hanno un etanolo contempido fino al 25%.
Trattamento del dolore
L'etanolo è usato per la lisi terapeutica dei nervi o dei gangli per il sollievo del dolore intrattabile cronico, presente nel cancro inoperabile o in una nevralgia del trigemino.
Trattamento delle cisti tiroidei sintomatiche
Le iniezioni percutanee di etanolo sono utilizzate nel trattamento delle cisti tiroidee, una semplice procedura che potrebbe evitare complicanze dell'intervento chirurgico.
Azione sedativa
Occasionalmente, l'etanolo viene somministrato per via endovenosa per la sedazione preoperatoria e postoperatoria, in quei pazienti a cui non sono utilizzabili altre misure.
Antidoto
L'etanolo viene utilizzato sistemico per il trattamento dell'avvelenamento con metanolo o glicolo etilenico.
Glaucoma
L'etanolo viene utilizzato per ridurre la pressione intraoculare nei pazienti con glaucoma.
Carburante
Gli Stati Uniti, insieme al Brasile, consumano il 90% di etanolo utilizzato come combustibile nelle auto. Gli Stati Uniti sono il più grande produttore di mais al mondo, quindi utilizza il mais come fonte di etanolo come carburante.
Il governo ha sovvenzionato i coltivatori di mais, che sono aumentati tra il 1979 e il 1986 la produzione di etanolo a combustibile di 20 milioni di galloni all'anno a 750 milioni di galloni.
La canna da zucchero è la principale fonte di etanolo in Brasile per l'uso come carburante. Nel 1943, a causa della seconda guerra mondiale.
Può servirti: deuterioDal 1976 sono stati usati come combustibile nelle miscele di auto di etanolo e benzina, il cui contenuto di etanolo varia tra il 10 e il 25 %, a seconda della produzione di canna da zucchero.
Uso ricreativo
L'etanolo è presente in numerosi drink usati nelle riunioni sociali e anche durante la cena a pranzo e in famiglia.
L'azione iniziale dell'alcol per disinibire il comportamento sociale della persona produce un ambiente piacevole e facilitante dell'interazione tra le persone. Tuttavia, l'etanolo in eccesso può far esplodere effetti tossici e indesiderabili sulla salute personale e in armonia tra incontri o eventi.
Cura personale
L'etanolo è presente in molti cosmetici e prodotti di bellezza. Inoltre, grazie alla sua azione astringente viene utilizzato nella pulizia della pelle, eliminando il grasso e gli sporchi resti che l'acqua e il sapone non lo fanno. Fa anche parte della preparazione di molte lozioni e profumi.
Cibo
L'essenza della vaniglia, un sapore di utilizzo in torte e torte, viene sciolta in una miscela di etanolo e acqua. Le caramelle che sono piene di determinate bevande alcoliche sono vendute. L'alcol è anche usato come assaggio di alcuni dolci.
Ottenere alcol etilico
L'etanolo è principalmente ottenuto dalla fermentazione dello zucchero e dall'idratazione dell'etilene, per produrlo da anidride carbonica, lipidi e cellulosa.
Fermentazione
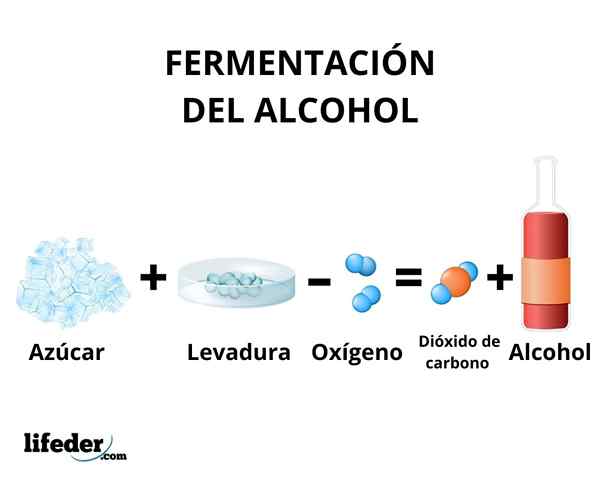
Nel processo di fermentazione la trasformazione dei carboidrati in etanolo avviene dall'azione degli enzimi presenti nel lievito. Principalmente, canna da zucchero, barbabietola e cereali come mais e orzo sono usati come materie prime.
Gli enzimi della glicolisi di alcune specie di lievito, come Saccharomyces cerevisiae, Sono in grado di agire su zuccheri di glucosio e saccarosio, al fine di produrre etanolo. La concentrazione di etanolo prodotto è limitata dalla suscettibilità dei lieviti all'etanolo.
In ogni caso, la concentrazione di etanolo prodotto dalla fermentazione non supera il 18%. È necessario concentrare la soluzione di etanolo usando una semplice distillazione. Attraverso questo metodo si ottiene una soluzione di etanolo con una concentrazione di circa il 95%.
Infine, vengono utilizzate distillazione frazionata e disidratazione alcolica al 95% per la produzione assoluta alcol. L'etanolo prodotto dalla fermentazione viene utilizzato in medicina ed è riservato come un combustibile che completa la benzina.
Idratazione etilene
In questo processo, l'etilene viene miscelato con alte temperature con vapore deionizzato ad alte temperature, tra 250 e 300 ° C e sotto una pressione di 6.8 MPA. La conversione dell'etilene in etanolo è catalizzata dall'acido fosforico posizionato su un letto terrestre di silice o diatomee.
Può servirti: proprietà meccaniche dei metalliLa reazione di idratazione dell'etilene può essere schematizzata come segue:
C2H4 + H2O → Ch3Cap2OH
Parte dell'acido fosforico viene trascinato dal vapore acqueo e deve essere neutralizzata con idrossido di sodio diluito. La concentrazione di etanolo ottenuta dall'idratazione dell'etilene è bassa, con un valore compreso tra il 10 e il 25%.
Quindi, la soluzione di etanolo è concentrata dalla distillazione, ottenendo una soluzione di etanolo al 95%, che può essere eseguita al 100% mediante distillazione frazionaria e disidratazione.
Altri metodi
Da metodi alternativi per la produzione di etanolo abbiamo l'uso di anidride carbonica, lipidi e cellulosa. L'uso della cellulosa è più promettente, poiché materiali come legno, paglia, documenti di scarto, ecc., come fonte di materia prima di cellulosa. La cellulosa è un polimero di glucosio e può essere utilizzata come fonte di questo carboidrato.
Tossicità e rischi
 Le barche alcoliche fatte in casa si trovano di solito in una concentrazione del 70%-90%
Le barche alcoliche fatte in casa si trovano di solito in una concentrazione del 70%-90% Inalazione
Alte concentrazioni di vapore di etanolo possono causare sonnolenza, irritazione agli occhi e tratto respiratorio superiore, manifestate per tosse e mal di testa.
Contatto diretto con la pelle e gli occhi
Il contatto con la pelle può causare secchezza e, cronica, irritazione e dermatite. Nel frattempo, il contatto visivo produce irritazione, arrossamento, dolore e sensazione di combustione.
Ingestione
Produce una sensazione di combustione e inizialmente ha un'azione stimolante e piacevole a causa della disinibizione prodotta. Ma quando l'assunzione di alcol continua, c'è una depressione nervosa, mal di testa, visione offuscata, sonnolenza e incoscienza.
Effetti cronici
L'etanolo colpisce il sistema nervoso centrale e il tratto respiratorio superiore. Inoltre, il danno epatico causato dall'ingestione di etanolo può portare alla cirrosi e, successivamente, alla morte.
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Etanolo. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Etanolo. Pubchem Comunund Sommario per CID 702. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Storia dell'etanolo. (2011). Storia dell'etanolo - dall'alcol al carburante per auto. Recuperato da: etanolhistory.com
- I redattori di Enyclopedia Britannica. (2020). Etanolo. Recuperato da: Britannica.com
- CORQUIVEN. (15 ottobre 2000). SCHEDA DI SICUREZZA (MSDS) Alcol etilico. [PDF]. Recuperato da: iio.INS.Uabc.MX
- Byju's. (2020). Usi di metanolo ed etanolo. Recuperato da: byjus.com
- Helmestine, Anne Marie, PH.D. (25 agosto 2020). La differenza tra alcol ed etanolo. Recuperato da: Thoughtco.com

