Assorbanza ciò che è, esempi ed esercizi risolti
- 4229
- 1236
- Baldassarre Ross
IL assorbanza È il logaritmo con un segno negativo del quoziente tra l'intensità della luce emergente e l'intensità dell'incidente della luce su un campione di soluzione traslucida che è stata illuminata con luce monocromatica. Questo quoziente è il trasmissione.
Viene chiamato il processo fisico del passaggio della luce attraverso un campione trasmissione luminosa, E l'assorbanza ne è una misura. Quindi, l'assorbanza diventa il minor logaritmo di trasmittanza ed è un fatto importante per determinare la concentrazione di un campione che viene generalmente sciolto in un solvente come acqua, alcol o qualsiasi altro.
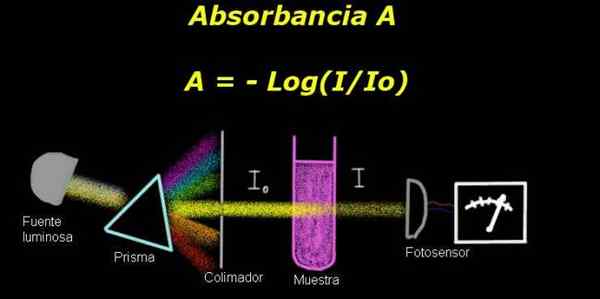
 Figura 1. Schema del processo di assorbanza. Preparato da f. Zapata
Figura 1. Schema del processo di assorbanza. Preparato da f. Zapata Per misurare l'assorbanza, è richiesto un dispositivo Elettro-fotometro, con cui viene misurata una corrente proporzionale all'incidente di intensità luminosa sulla sua superficie.
Quando si calcola la trasmittanza, il segnale dell'intensità corrispondente al solo solvente viene generalmente misurato e questo risultato viene registrato come Io.
Quindi viene posizionato il campione sciolto nel solvente con le stesse condizioni di illuminazione. La misura misurata dall'elettro-fotometro è indicata come Yo, che consente di calcolare la trasmittanza T Secondo la seguente formula:
T = i / iO
È una quantità scatenata. IL Assorbanza a Questo è espresso come:
A = - log (t) = - log (i / iO)
[TOC]
Assorbanza e assorbimento molare
Le molecole che compongono una sostanza chimica sono in grado di assorbire la luce e una misura di ciò è assolutamente. È il risultato dell'interazione tra fotoni ed elettroni molecolari.
Pertanto è una grandezza che dipenderà dalla densità o dalla concentrazione delle molecole che compongono il campione e anche del percorso ottico o della distanza percorsa dalla luce.
Puoi servirti: la terza legge di Newton: applicazioni, esperimenti ed eserciziI dati sperimentali indicano che l'assorbanza A è linearmente proporzionale alla concentrazione C e distanza D Luce viaggiata. Quindi, per calcolarlo in base a questi parametri, è possibile stabilire la seguente formula:
A = ε⋅c⋅D
Nella formula precedente, ε È una costante di proporzionalità conosciuta con il nome di Assorbimento molare.
L'assorbità molare dipende dal tipo di sostanza e dalla lunghezza d'onda con cui viene misurata l'assorbanza. IL Assorbimento molare È anche sensibile alla temperatura del campione e al pH dello stesso.
Legge della birra-lambert
Questa relazione tra assorbanza, assorbità, concentrazione e distanza dallo spessore del percorso che la luce segue all'interno del campione è nota come legge della birra-lambert.
 figura 2. Legge sulla birra - Lambert. Fonte: f. Zapata,
figura 2. Legge sulla birra - Lambert. Fonte: f. Zapata, Di seguito ci sono alcuni esempi di come usarlo.
Esempi
Esempio 1
Durante un esperimento un campione con una luce rossa di luci laser a neon elio, la cui lunghezza d'onda è 633 nm. Un elettro-fotometro misura 30 mV quando la luce laser colpisce direttamente e 10 mV quando passa attraverso un campione.
In questo caso, la trasmittanza è:
T = i / io = 10 mV / 30 mV = ⅓.
E l'assorbanza è:
A = - log (⅓) = log (3) = 0.48
Esempio 2
Se la stessa sostanza è posizionata in contenitore che ha metà dello spessore.
Si deve considerare che se lo spessore diminuisce alla metà, allora l'assorbanza proporzionale allo spessore ottico diminuisce della metà, vale a dire a = 0,28. Le tonnellate di trasmissione saranno fornite dalla seguente relazione:
Può servirti: scatto verticale: formule, equazioni, esempiT = 10-a = 10^(-0.28) = 0,53
L'elettro-fotometro segnerà 0,53*30 mV = 15,74 mV.
Esercizi risolti
Esercizio 1
Voleva determinare l'assorbità molare di un determinato composto brevettato che è in soluzione. Per questo, la soluzione con luce da una lampada di sodio da 589 nm è illuminata. Il campione verrà posizionato su uno spessore di 1,50 cm.
Si basa su una soluzione di concentrazione 4,00 × 10^-4 moli per litro e la trasmittanza viene misurata con conseguente 0,06. Determinare con questi dati l'assorbità molare del campione.
Soluzione
In primo luogo, viene determinata l'assorbanza, che è definita come il minimo logaritmo basato su dieci di trasmittanza:
A = - log (t)
A = - log (0,06) = 1,22
Quindi viene utilizzata la legge di Lambert-Beer che stabilisce una relazione tra assorbanza, assorbimento molare, concentrazione e lunghezza ottica:
A = ε⋅c⋅D
Cancamento dell'assorbità molare si ottiene la seguente relazione:
ε = a/(c⋅d)
Sostituzione dei valori dati:
ε = 1.22/(4,00 × 10^-4 m⋅1,5 cm) = 2030 (m⋅cm)^-1
Il risultato precedente è stato arrotondato a tre cifre significative.
Esercizio 2
Al fine di migliorare l'accuratezza e determinare l'errore della misura dell'assorbimento molare del campione nell'esercizio 1, il campione viene successivamente diluito nella metà della concentrazione e la trasmittanza viene misurata in ciascun caso.
A partire da CO = 4 × 10^-4 m con trasmittanza t = 0,06 si ottiene la seguente sequenza di dati per la trasmittanza e l'assorbanza calcolata dalla trasmittanza:
CO/1-> 0,06-> 1.22
CO/2-> 0,25-> 0,60
CO/4-> 0,50-> 0,30
CO/8-> 0,71-> 0,15
CO/16-> 0,83-> 0,08
CO/32-> 0,93-> 0,03
CO/64-> 0,95-> 0,02
CO/128-> 0,98-> 0,01
CO/256-> 0,99-> 0,00
Con questi dati, fai:
Può servirti: onde stazionarie: formule, caratteristiche, tipi, esempia) Un grafico di assorbanza basato sulla concentrazione.
b) una regolazione lineare dei dati e trovare la pendenza.
c) Dalla pendenza ottenuta, calcola l'assorbimento molare.
Soluzione
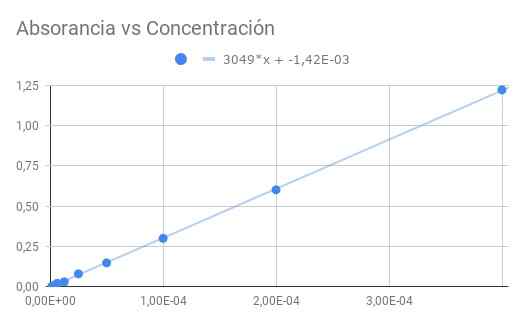 Figura 3. Assorbanza vs concentrazione. Fonte: f. Zapata.
Figura 3. Assorbanza vs concentrazione. Fonte: f. Zapata. La pendenza ottenuta è il prodotto dell'assorbanività molare per distanza ottica, quindi dividendo la pendenza per lunghezza 1,5 cm otteniamo assorbimento molare
ε = 3049/1,50 = 2033 (m⋅cm)^-1
Esercizio 3
Con i dati dell'esercizio 2:
a) Calcola l'assorganività per ciascun dati.
b) Determinare un valore medio per l'assorbità molare, la sua deviazione standard e l'errore statistico associato alla media.
Soluzione
L'assorbimento molare viene calcolato per ciascuna delle concentrazioni testate. Ricordiamo che le condizioni di illuminazione e la distanza ottica rimangono fissate.
I risultati per l'assorbità molare sono:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1.872, 1862 in unità di 1/(m*cm).
Da questi risultati possiamo prendere il valore medio:
= 1998 (m*cm)^-1
Con una deviazione standard di: 184 (m*cm)^-1
L'errore medio è la deviazione standard divisa per la radice quadrata del numero di dati, cioè:
Δ = 184/9^0,5 = 60 (m*cm)^-1
Infine, si è concluso che la sostanza brevettata ha un assorbimento molare a frequenza 589 nm prodotta da una lampada di sodio di:
= (2000 ± 60) (m*cm)^-1
Riferimenti
- Atkins, p. 1999. Chimica fisica. Omega Editions. 460-462.
- La guida. Trasmittanza e assorbanza. Recuperato da: chimica.Laguia2000.com
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Recuperato da: repository.Innovationumh.È
- Fisica dell'avventura. Assorbanza e trasmittanza. Recuperato da: rpfisica.Blogspot.com
- Sistofotometria. Recuperato da: Chem.Librettexts.org
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Recuperato da: repository.Innovationumh.È
- Wikipedia. Assorbanza. Recuperato da: Wikipedia.com
- Wikipedia. Spettrofotometria. Recuperato da: Wikipedia.com
- « Contesto, caratteristiche, autori, caratteristiche, autori della latinoamericano
- Origini, caratteristiche, cause e conseguenze totalitarismo »

